Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Цепь переноса электронов и окислительное фосфорилирование
Регуляция дыхания, разобщение и обменные реакции
При должной осторожности можно получить относительно неповрежденные митохондрии. Для них характерно жесткое сопряжение. Под этим выражением мы подразумеваем, что электроны не могут пройти по цепи переноса электронов, не генерируя АТР. Более того, если концентрации ADP или Pi окажутся слишком низкими, то прекращается одновременно и фосфорилирование, и дыхание. Такой дыхательный контроль является свойством неповрежденных митохондрий. С другой стороны, поврежденные митохондрии или субмитохондриальные частицы часто способны осуществлять быстрый перенос электронов без синтеза АТР; при этом не наблюдается ингибирования низкими концентрациями ADP. Близко к этому явлению стоит разобщение, вызываемое различными соединениями, из которых наиболее известен 2,4-динитрофенол. Еще до открытия явления разобщения, было известно, что динитрофенол значительно повышает скорость дыхания у животных. Это соединение было даже использовано (с некоторыми печальными результатами) для изготовления таблеток, понижающих вес тела. Химическая основа разобщения пока неизвестна, но одна из возможностей указана в уравнении (10-11), в котором представлена чисто гипотетическая химическая модель окислительного фосфорилирования. На этой схеме в цепи переноса электронов функционирует три переносчика А, В и С. Переносчик С обладает более выраженными окислительными свойствами по сравнению с переносчиками А и В, а переносчик В имеет особую химическую способность реагировать в восстановленном состоянии с белком Y, образуя комплекс Y—ВН2. Этот неидентифицированный аддукт окисляется переносчиком С в высокоэнергетическую окисленную форму, обозначенную как Y~B. Если допустить возможность образования такого промежуточного соединения, то далее нетрудно представить возможные пути превращения энергии этого соединения в уже знакомые нам формы. Например, еще один белок X может реагировать с упомянутым выше соединением, образуя комплекс X—Y, в котором белки связаны тиоэфирной, ацилфосфатной или другой высокоэнергетической связью. Можно даже не рассматривать систему из двух белков, а обойтись одним, в котором X и Y будут представлять различные функциональные группы. Рассматриваемые компоненты не обязательно должны быть белками. Например, Y может быть фосфолипидом.
Таблица 10-3 Некоторые искусственные акцепторы электронова,б
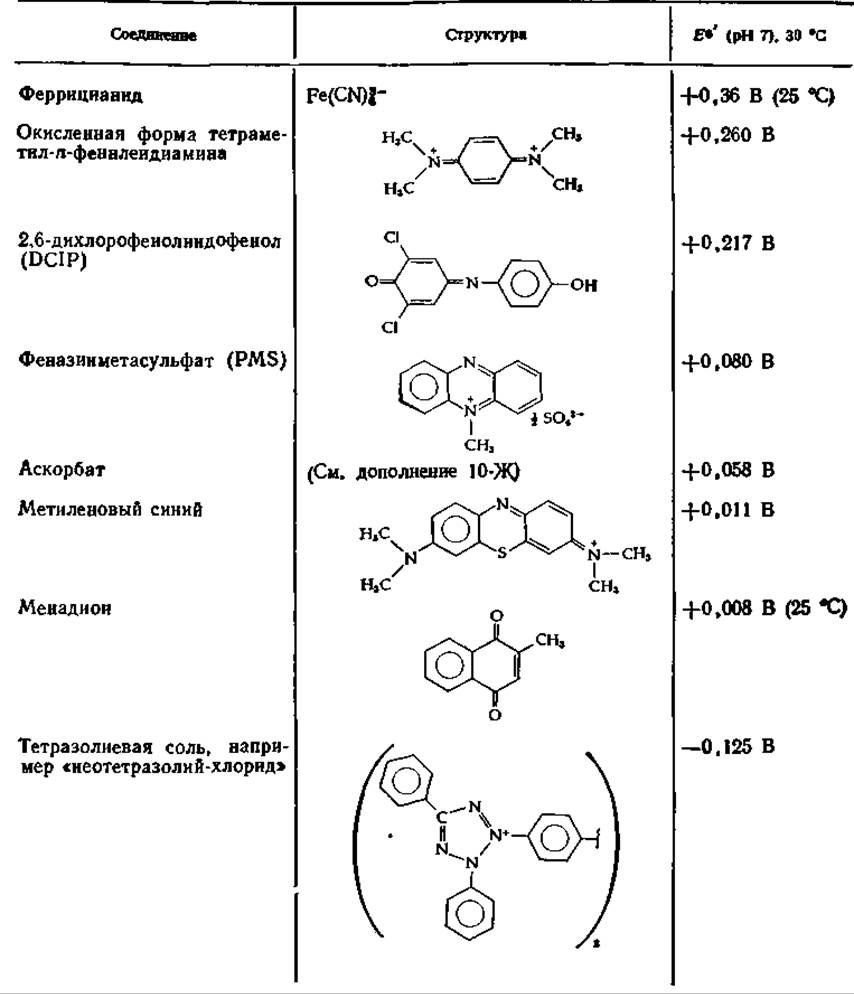
а По данный Вайнно [59], стр. 106—111.
б Места действия указаны на рис. 10-11.
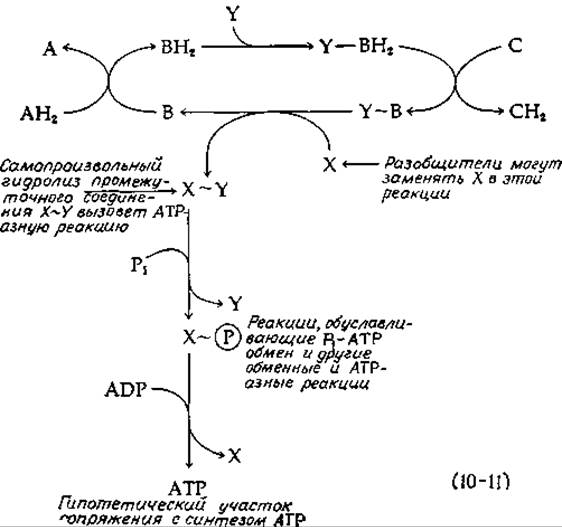
Образование АТР в ходе остальных реакций уравнения (10-11) происходит просто. Пусть, например, X~Y — это тиоэфир, тогда образование АТР произойдет в результате обращения последовательности S1A, приведенной в табл. 7-2. Эти же стадии лежат в основе различных обменных реакций. Например, митохондрии катализируют обмен неорганического фосфата (Н32РС2-4) с концевым фосфатом АТР. Митохондрии и субмитохондриальные частицы обладают также АТР-гидролизующей (АТРазной) активностью. Хотя гидролиз АТР, по-видимому, не является физиологической реакцией, имеется строгая корреляция между АТРазной активностью н способностью субмитохондриальных частиц катализировать окислительное фосфорилирование. По-видимому, и АТРазнaя активность обменные реакции осуществляются по тому же механизму, который обеспечивает синтез АТР в митохондриях с жестким сопряжением. На схеме, представленной в уравнении (10-11), для проявления АТРазной активности достаточно, чтобы был возможен самопроизвольный гидролиз X~Y. Частичное разрушение системы могло бы приводить к усилению АТРазной активности, что и наблюдается в эксперименте. Далее легко себе представить, что разобщители, такие, как динитрофенолят или арсенат-ионы, ведут себя как нуклеофильные замещающие группы и могут выступать в процессе вместо X. Самопроизвольный распад лабильных промежуточных соединений должен был бы обеспечить беспрепятственный ход процессов окисления. Это было бы особенно существенно в том случае, когда X полностью связывается в комплексе X~Y и не может подвергаться дальнейшим превращениям из-за отсутствия неорганического фосфата. Поскольку имеется три различных участка фосфорилирования, то можно ожидать, что имеется три разных фермента типа Y, однако при этом наблюдается только один X.
Другим наблюдением, согласующимся со схемой уравнения (10-11), является ингибирование окисления NADH антибиотиком олигомицином (рутамицином). Это соединение ингибирует также митохондриальную АТРазную активность. Однако ингибирующее действие снижает динитрофенол, что свидетельствует о связывании олигомицина с ферментом, катализирующим обменные реакции, а не с самой цепью переноса электронов. Важным экспериментальным открытием явились данные о способности «шишковидных выступов», различимых на негативно окрашенных митохондриальных фрагментах, катализировать как АТРазную, так и обменные реакции. Содержащийся в них белок F1 (разд. Д,8) является одним из нескольких «факторов сопряжения», необходимых для реконструкции фосфорилирующей системы из разрушенных митохондрий.
Мы еще вернемся к схеме сопряжения, представленной в уравнении (10-11), но читателю следует иметь в виду, что все попытки идентифицировать промежуточное соединение типа X~Y успеха не дали. Более того, большинство заявлений о том, что удалось обнаружить соединение Y~B, было опровергнуто.
Дополнение 10-Д
Использование метаболизма для выработки тепла: термогенные ткани
Вторая по значению, но тоже важная роль метаболизма теплокровных животных — это генерирование тепла. Во многих случаях тепла, выделенного в ходе обычного метаболизма, оказывается вполне достаточно, и организм может поддерживать необходимую температуру тела, регулируя теплообмен с окружающей средой. Весьма интригующей биохимической находкой оказалось наличие у теплокровных животных бурой Жировой ткани, разительным образом отличающейся от нормальной белой жировой ткани. Бурый жир в небольших количествах был обнаружен у новорожденных детей; у новорожденных крольчат он составляет 5—6% веса телаа-в. Особенно в большом количестве он встречается у новорожденных тех видов, которые при рождении не имеют меха, а также у животных, впадающих в зимнюю спячку. Согласно существующий представлениям, функция этой ткани состоит в том, чтобы генерировать тепло. Необычно высокая концентрация кровеносных сосудов и митохондрий, большое число симпатических нервных волокон — все эти признаки бурой жировой ткани связаны с эффективным генерированием тепла. Остается нерешенным интересный биохимический вопрос: рассеивается ли энергия, освобождающаяся при переносе электронов в митохондриях, в виде тепла в результате разобщения синтеза АТР и переноса электронов? Или же синтез АТР происходит, но образующийся АТР бесполезно гидролизуется под действием активной АТРазы?
Некоторые растительные ткани обладают термогенной активностью. Например, початок Symplocarpus foetidus (симплокарпуса) может поддерживать температуру на 10—25 °С выше температуры воздухав,г.
Жук-бомбардир вырабатывает горячую защитную жидкость, содержащую хиион, которую он испускает из специальной камеры, причем температура испускаемой жидкости достигает 100 °С. В особом резервуаре запасается реакционная смесь, содержащая 25% перекиси водорода и 10% гидрохинона и метилгидрохииона [см. прилагаемый рисунок, где буквой Е обозначен фермент, а М — мышечный канал (из работы Анешанслея и др.д)]. Когда эта смесь приходит в контакт с каталазой и пероксидазой, находящимися в камере, возникает взрывная силав,д,е. Примечательна и система синтеза и хранения 25% Н2О2, в связи с организацией которой возникают некоторые интересные биохимические вопросы.
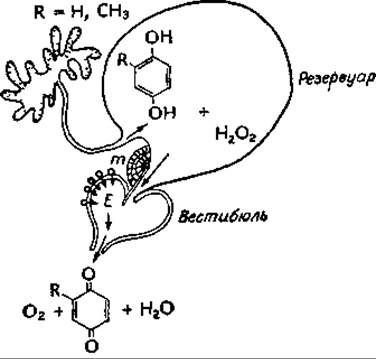
а Lindberg О., ed., Brown Adipose Tissue, Am. Elsevier, New York, 1970.
б Dawkins M. J. R.. Hull D., Sсi. Am., 213, 62—67 (1965).
в Hochachka P. W., Fed. Proc., Fed. Am. Soc. Exp. Biol., 33, 2162—2169 (1974).
г Bahr J. T., Bonner W. D., Jr., JBC, 248, 3441—3445 (1973).
д Aneshansley D. J., Eisner T., Widom J. M., Widom В., Science, 165, 61— 63 (1969).
е Eisner T., Meinwald J., Science, 153, 1341—1350 (1966).
в. «Состояния» митохондрий и спектрофотометрические наблюдения
Чанс н Вильямс [68] установили существование пяти состояний митохондрии, из которых состояние 3 и 4 часто упоминаются в текущей литературе. Определение всех пяти состояний дано в табл. 10-4. Заметим, что эти определения относятся только к митохондриям с жестким сопряжением. Такие митохондрии, находясь в состоянии активного фосфорилирования (состояние 3), далее самопроизвольно переходят в Состояние 4, в котором весь ADP уже превратился в АТР.
Таблица 10-4 Состояния жестко сопряженных митохондрий
|
Варьируемые условия |
Состояние 1: без добавлення субстрата |
Состояние 2: митохондрии взяты от голодающих животных |
Состояние 3: активное фосфорилирование |
Состояние 4: истощение запаса ADP |
Состояние 5: анаэробное |
|
О2 |
+ |
+ |
+ |
+ |
Отсутствует |
|
[ADP] |
Низкая |
Высокая |
Высокая |
Низкая |
Высокая |
|
Концентрация окисляемого субстрата |
» |
—0 |
» |
Высокая |
» |
|
Скорость дыхания |
Медленная |
Медленная |
Быстрая |
Медленная |
0 |
|
Лимитирующий компонент |
ADP |
Субстрат |
Цепь переноса электронов |
ADP |
О2 |
Таблица 10-5 Длины волн, при которых измерялся уровень окисления переносчиков в митохондриальной цепи переноса электронова
|
Переносчик |
λmах (нм)б |
λ0 (нм) |
Переносчик |
λmaх (нм)б |
λ0 (нм) |
|
NADH |
340 |
374 |
с2+ |
550 (а) |
540 |
|
Флавины |
465 |
510 |
521 (β) |
||
|
Цитохромы |
416 (у) |
||||
|
564 (а) 530 (β) 430 (у) |
575 |
а2+ |
605 (а) 450 (у)а |
630 (595) |
|
|
с2+1 |
534 (а) 523 (β) 418 (у) |
а2+3 |
600 (а)а 445 (у) |
455 |
а По данный Чанса н Вильниса [68].
б Длины волн, которые одновременно использовались в двухволновом спектрофотометре, приведены в одной строке. Для цитохромов даны положения еще нескольких полос поглощения.
Чанс с сотрудниками провел спектрофотометрические наблюдения на интактных митохондриях и субмитохондриальных частицах, исследуя при этом как последовательность переносчиков, так и участки фосфорилирования. В этих экспериментах был использован двухволновой спектрофотометр, который позволял регистрировать поглощение при длине волны λmах (максимум поглощения для данного соединения) относительно поглощения при другой длине волны λ0. Основные длины волн, использованные в эксперименте, приведены в табл. 10-5.
По этим измерениям можно было судить о состоянии окисления или восстановления каждого из переносчиков для различных состояний, приведенных в табл. 10-4, а также в присутствии ингибиторов. Эксперименты дали возможность убедиться в том, что электроны, проходя по цепи, действительно какое-то время находятся на данном переносчике. Иначе говоря, в данном состоянии каждый переносчик имеет определенное соотношение окисленной и восстановленной форм,) [окисл.]/[восстан.]. Такого результата, вероятно, не наблюдалось бы, если бы вся цепь функционировала кооперативным образом, с прохождением электронов вдоль всей цепи в ходе единой реакции. Кроме того, наблюдая изменения в отношении [окисл.]/[восстан.]| в различных условиях, можно в какой-то мере локализовать три участка фосфорилирования. В одном из экспериментов для блокирования всей цепи выше цитохрома с1 использовался антимицин а. Затем, при истощении запаса ADP, жестко сопряженные митохондрии переходили в состояние 4. Поскольку концентрация кислорода была высокой, а у цитохрома а3 значение КМ Для О2 невелико (~3 мкМ), то цитохром а3 поддерживался в высокоокисленном состоянии. Цитохром а тоже оставался окисленным, но цитохромы c1и с были в восстановленном состоянии. Наличие такого пункта перекреста давало основание считать, что одни из участков «запасания» энергии лежит где-то вблизи цитохрома с. Более поздние эксперименты, в которых использовался тот же подход, описаны в работах Вильсона и др. [72—75].