Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Роль восстановителей в реакциях биосинтеза
Регуляция восстановительной способности систем, содержащих NAD и NADP
Судя по всему, в клетках имеется тенденция к поддержанию отношения [NAD+]/[NADH] на некотором постоянном уровне и в равновесии с различными парами восстановительных и окислительных субстратов. Так, в цитоплазме клеток печени крысы все реакции дегидрирования, катализируемые лактатдегидрогеназой, енглицерофосфат—дегидрогеназой и малатдегидрогеназой, находятся в равновесии с одним и тем же отношением [NAD+]/[NADH] [7]. Если печень извлечь из крысы и быстро заморозить ее (быстрее, чем за 8 с)1) и определить после этого концентрации различных компонентов цитоплазмы, то оказывается, что отношение [NAD+]/[NADH] составляет 634, тогда как отношение [Лактат]/[Пируват] равно 14,2. Исходя из этих данных, была рассчитана величина кажущейся константы равновесия реакции b в уравнении (11-9), которая оказалась равной К'c = 9,0∙103, т. е. практически такой же, как и величина истинной константы равновесия этой реакции, составляющая, согласно данным, полученным в опытах in vitro, 8,8∙103:
![]()
1) Для этой цели была использована специальная методика (см разд. Е,4).
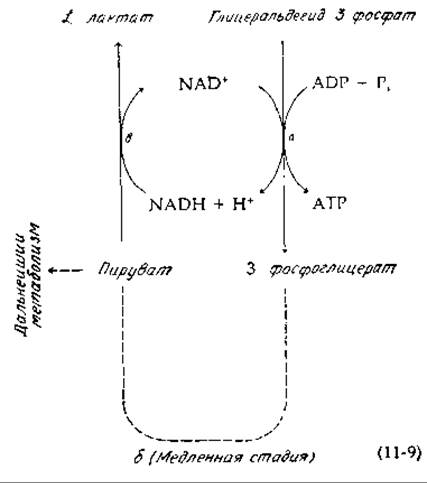
Аналогичным путем можно показать, что несколько других реакций дегидрирования также находятся в состоянии, близком к равновесному.
Рассмотрим теперь стадию а реакции (11-9), т. е реакцию окисления глицеральдегид-3-фосфата, требующую присутствия ADP и Pi (рис. 8-13). Экспериментальные данные показывают, что в цитоплазме эта реакция также находится в состоянии равновесия. В серии опытов соотношение [ATP]/[ADP] ∙ [Pi], характеризующее состояние фосфорилирования, оказалось равным 709, тогда как соотношение [3-фосфоглицерат]/[глицеральдегид-3-фосфат] составило 55,5. Суммарная константа равновесия для стадии а в реакции (11-9) выражается следующим образом:
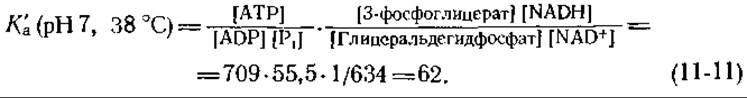
Эта величина, вычисленная из известных констант равновесия, равна 60.
Исходя из этих данных, Кребс (Krebs) и Вич (Veech) пришли к выводу, что состояние окисления системы, содержащей NAD, определяется в основном соотношением, характеризующим степень фосфорилирования адениннуклеотидной системы [9] Если концентрация АТР высока, то равновесие стадии а в реакции (11-9) будет достигаться при большом избытке NAD+ по сравнению с NADH и нужное соотношение [Лактат]/[Пируват] будет устанавливаться за счет окисления лактата до пирувата.
Важно не путать реакции, описываемые уравнением (11-9), когда они протекают в анаэробных клетках, с тесно сопряженной парой окислительно-восстановительных реакций в случае гомоферментативного молочнокислого брожения (гл. 9, разд. Е, 1, а). Смысл вывода, к которому пришли Кребс и Вич, состоит по существу в том, что стадии а и β в уравнении (11-9) находятся в большинстве случаев в равновесии, а стадия б может протекать относительно медленно. Кроме того, следует иметь в виду, что пируват утилизируется во многих других метаболических реакциях, а АТР гидролизуется и превращается в ADP в результате многочисленных процессов, протекающих в клетке. Восстановленный NAD не вступает в цикл между двумя ферментами в стехиометрических количествах, и образующиеся «восстановительные эквиваленты» NADH в большей части переносятся в митохондрии. Смысл реакций, описываемых уравнением (11-9) состоит в том, что окислительно-восстановительные пары составляют окислительно-восстановительную буферную систему определенного типа, которая поддерживает отношение [NAD+]/[NADH] на уровне, необходимом для ее метаболического функционирования.
Несколько неожиданным оказался тот факт, что отношение [NAD+]/[NADH] в митохондриях приблизительно в 100 раз ниже, чем в цитоплазме. Если даже митохондрии представляют собой именно те места, в которых NADH окисляется до NAD+, то интенсивная катаболическая активность, имеющая место при ß-окислении, и цикл трикарбоновых кислот обеспечивают очень быстрое образование NADH. Кроме того, восстановленное состояние NAD, по-видимому, поддерживается низким потенциалом лары ß-оксибутират—ацетоацетат (гл. 10, разд. Д, 7). Митохондриальные пиридиннуклеотиды также, судя по всему, находятся в равновесии с глутаматдегидрогеназой [9].
Возникает вопрос: каким образом в цитоплазме отношение [NADPH]/[NADP+] устанавливается и поддерживается на более высоком уровне, чем отношение [NADH]/[NAD+]? Одной из реакций, которая рассматривалась выше, является трансгидрирование:
![]()
Имеются растворимые ферменты, катализирующие эту реакцию, для которых величина К близка к единице. Содержащаяся в митохондриях энергозависимая система (гл. 10, разд. Д, 10), включающая мембраны, ускоряет эту реакцию и смещает равновесие в сторону более высокого содержания NADPH. В цитоплазме же эта система, по-видимому, не функционирует.
Другой очевидный путь, который мог бы приводить к увеличению соотношения [NADPH]/[NADP+], состоит в превращении NADH в NADPH путем переноса фосфатной группы от ATP. NADP+; образующийся после использования NADPH, мог бы гидролизоваться фосфатазой до NAD+ и вновь превращаться в NADH в результате одной из многочисленных катаболических реакций. Процесс должен был бы идти почти строго параллельно последовательности фосфорилирование — дефосфорилирование, используемой в сопряженном процессе расщепления АТР и активации сульфата [уравнение (11-4)]. Хотя эта идея представляется вполне правдоподобной и привлекательной, однако в настоящее время мы не располагаем доказательствами того, что указанный путь увеличения концентрации NADH действительно реализуется в организмах.
Основной путь сопряжения процесса расщепления АТР и восстановления NADP+ в организме человека состоит в карбоксилировании с последующим декарбоксилированием. Один цикл, сопровождающий такого рода превращение, показан в уравнении (11-13). Первая стадия [стадия а, уравнение (11-13)] представляет собой ATP-зависимое карбоксилирование пирувата до оксалоацетата — реакцию, активно протекающую в митохондриях [уравнение (8-2)]. Получающийся при этом оксалоацетат может быть восстановлен под действием NADH-зависимой малатдегидрогеназы [стадия б, уравнение (11-13)], причем образующийся малат может выходить из митохондрий в цитоплазму. В цитоплазме малат окисляется до пирувата [стадия в, уравнение (11-13)] и декарбоксилируетcя при помощи соответствующего «яблочного» фермента (гл. 9, разд. Б.5), специфического в отношении NADP+ и обладающего очень высокой активностью. Этот фермент «работает» в цитоплазме при равновесии (или вблизи равновесия). Исходя из этого и используя известные значения констант равновесия, легко показать, что равновесное соотношение [NADP+]/[NADPH] должно быть приблизительно в 105 меньше, чем равновесное соотношение [NAD+]/[NADH] [9, 10].
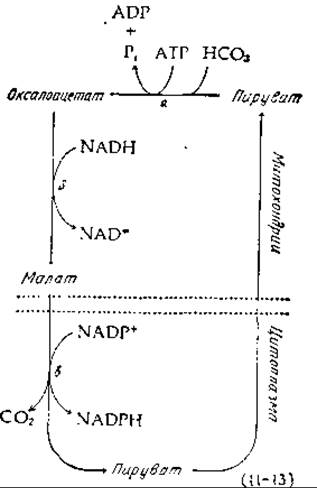
Заметим, что, поскольку NADPH непрерывно используется в биосинтетических реакциях, превращаясь при этом в NADP+, цикл, приведенный в уравнении (11-13), должен функционировать непрерывно. Также как и в случае реакций (11-9), истинное равновесие в этом цикле не достигается, однако стадии б и в практически равновесны. Эти равновесные состояния в сочетании с соответствующим равновесием, достигаемым в реакциях (11-9) для системы с NAD, поддерживают правильный окислительно-восстановительный потенциал обоих пиридиннуклеотидных коферментов в цитоплазме.
Следует обратить внимание еще на один аспект реакции (11-13): малат не единственная форма, в виде которой C4-соединения поступают из митохондрий в цитоплазму. Многие оксалоацетаты соединяются с ацетил-СоА, образуя цитрат, который выходит из митохондрий в цитоплазму и расщепляется цитратрасщепляющим ферментом [уравнение (7-70)]. В результате в цитоплазме появляется ацетил-СоА, необходимый для синтеза липидов, и оксалоацетат, который может либо восстанавливаться до малата, либо превращаться в аспартат. После выхода из митохондрий аспартат в результате другой реакции переаминирования может снова превращаться в оксалоацетат. Все эти превращения являются частью неравновесных процессов, в ходе которых соединения с четырьмя C-атомами диффундируют из митохондрий до завершения последовательности реакций, описываемой уравнением (11-13), и до вступления в другие метаболические процессы. Заметим, что последовательность реакции (11-13) приводит к выходу восстанавливающих эквивалентов из митохондрий, т. е. к процессу, противоположному процессам, катализируемым малат-аспартатным челночным механизмом (рис. 10-13). Эти два процесса активны, вероятно, в разных условиях.
Если различие в окислительно-восстановительных потенциалах двух пиридиннуклеотидных систем в животных тканях выражено четко, то в случае Е. coli потенциалы этих двух систем значительно меньше отличаются друг от друга [11].