Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Регуляция процессов биосинтеза
Синтез и катаболизм гликогена
Система, регулирующая образование и распад гликогена в мышцах животных, относится к числу наиболее хорошо изученных систем, контролирующих метаболические процессы [47—49]. Эта система схематически показана на рис. 11-10. Жирной прерывистой линией указано превращение гликогена в глюкозо-1-фосфат, катализируемое гликогенфосфорилазой (гл. 7, разд. В, 5; гл. 8, разд Д, 3,д).
Последовательность синтетических реакций, обеспечивающих получение UDPG и гликогена из глюкозо-1-фосфата, показана жирными сплошными линиями. В покоящейся мышце гликогенсинтетаза (Е3 на рис. 11-10) активна, тогда как фосфорилаза находится в неактивной форме, называемой фосфорилазой b (E2 на рис. 11-10). В обычных условиях неактивная фосфорилаза b аллостерически активируется АМР. Внезапный взрыв мышечной активности может привести к появлению АТР в количествах, достаточных для включения фосфоролиза гликогена.
Более важную роль в регуляции играют, однако, факторы, определяемые стимулирующим действием гормонов и нервной системы. Если концентрация адреналина в крови повышается, то этот гормон начинает связываться с рецепторами на поверхности клеточных мембран, активируя образование циклического АМР (гл. 7, разд. Д, 8). Аналогично в печени рецепторы глюкагона связывают этот гормон и стимулируют образование циклического АМР. Циклический АМР в свою очередь активирует протеинкиназы, которые модифицируют различные белки, в том числе киназу фосфорилазы (E1на рис. 11-10), а также гликоген-синтетазу. В покоящейся мышце киназа фосфорилазы находится в неактивной форме, и фосфорилирование протеинкиназой переводит ее в активную формуй, находясь в которой она катализирует фосфорилирование (за счет АТР) определенного серинового остатка в фосфорилазе b. Модифицированный (фосфорилированный) фермент, известный под названием фосфорилазы а, представляет собой нормальної активный фермент, ответственный за расщепление гликогена. Для фосфорилазы а характерен совсем другой путь аллостерической регуляции, который состоит в ингибировании фермента глюкозо-6-фосфатом (рис. 11-10). Таким образом, увеличение концентрации глюкозо-6-фосфата должно приводить к уменьшению скорости расщепления гликогена.
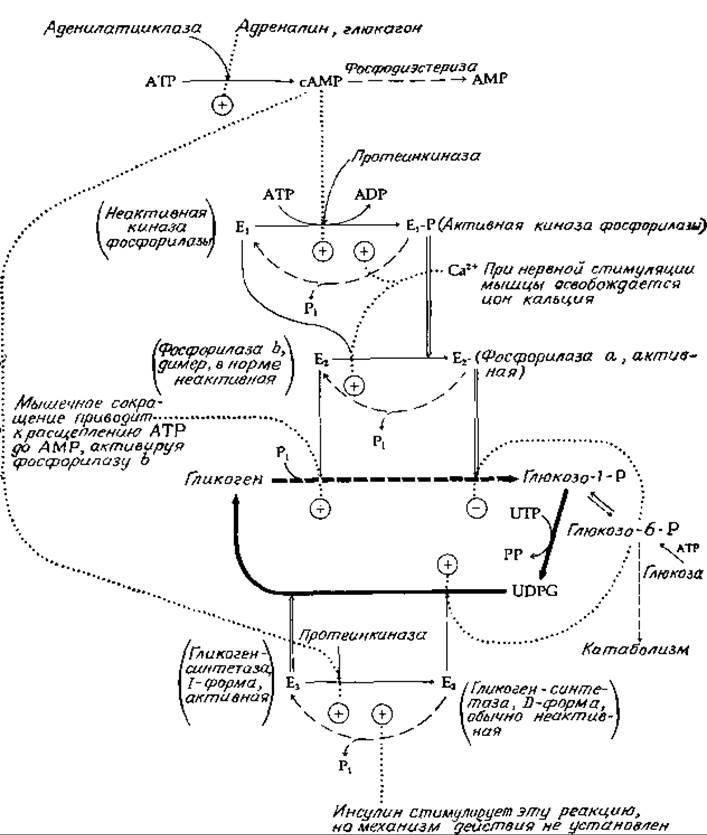
РИС. 11-10. Регуляция распада и синтеза гликогена в мышце: жирные непрерывные стрелки — синтез, штриховые (тонкие и жирные) стрелки — катаболизм, (→) — реакции фосфорилирования с использованием АТР, (→)—реакции гидролиза, катализируемые фосфатазами, и толстые светлые стрелки — влияние активных форм модифицируемых ферментов.
1) Киназа фосфорилазы — очень крупный фермент с мол. весом 1,3 млн., содержащий три типа субъединиц и имеющий, вероятно, состав a4ß4y4. Протеинкиназа, активность которой зависит от циклической АМР, фосфорилирует как а- так и ß-субъединицы, причем фосфорилирование именно ß-субъединиц, по-видимому, ответственно за активацию [49, 49а]. Киназа фосфорилазы может подвергаться также самоактивации, включающей фосфорилирование тех участков, на которые не действует протеинкиназа [49а].
Стимулируя действие фосфорилазы при помощи серии описанных выше механизмов, циклический АМФ активирует также протеинкиназу, после чего она начинает фосфорилировать активную форму (1-форму, или независимую форму) гликогенсинтетазы. При этом фосфорилированная форма гликогенсинтетазы (D-форма, или зависимая форма) неактивна в отсутствие специфического активатора. Таким образом, инициирование фосфоролиза гликогена сопровождается ингибированием дальнейшего синтеза гликогена. Фосфорилированная форма гликогенсинтетазы (D-форма) аллостерически активируется глюкозо-6-фосфатом. Следовательно, если имеет место быстрое повышение содержания метаболита, то это не только ингибирует фосфорилазную реакцию, но также стимулирует синтез гликогена, даже если вся гликогенсинтетаза превращена в неактивную форму (D-форму).
Так же как и другие киназы, протеинкиназа и киназа фосфорилазы требуют для своей активности ионы магния. Кроме того, киназа фосфорилазы в своей «неактивной» форме аллостерически активируется ионами кальция. Напомним, что инициирование процесса мышечного сокращения вызывается нервными импульсами, которые стимулируют освобождение ионов кальция из пузырьков эндоплазматического ретикулума. Таким образом, ионы кальция не только включают процесс мышечного сокращения, но и ускоряют процесс фосфорилирования фосфорилазы b в фосфорилазу а. Теперь некоторые этапы каскадного механизма становятся яснее. Оказывается, что наиболее важная стадия, катализируемая киназой фосфорилазы, нужна для того, чтобы дать возможность реализоваться следующей стадии, на которую оказывают специфическое влияние ионы кальция, освобождающиеся при нервном возбуждении. С другой стороны, возможность активации киназы фосфорилазы в результате фосфорилирования протеинкиназой делает процесс чувствительным к гормональной стимуляции.
Характерной особенностью регуляторных механизмов, зависимых от обратимой модификации белков, является существование специальных ферментов, «возвращающих» модифицированные белки в их исходное состояние «покоя»: циклический АМР гидролизуется фосфодиэстеразой до АМР, а все образующиеся фосфорилированные белки подвергаются гидролизу под действием фосфопротеинфосфатазы, в результате которого происходит удаление фосфатных групп [50]. Эти «релаксационные» реакции обозначены на рис. 11-10 пунктирными линиями. Действие фосфатаз также, несомненно, подвержено регуляции, однако о соответствующих механизмах нам мало что известно. Инсулин же при его введении в организм крыс, больных диабетом, стимулирует, вероятно, непрямым путем быстрое превращение неактивной формы (D-формы) гликогенсинтетазы печени в активную (1-форму) [51].
Наличие фосфорилазы и гликогенсинтетазы само по себе недостаточно для синтеза и расщепления гликогена. Как указывалось выше, синтез гликогена требует создания разветвления участков, образующихся в присутствии ветвящего фермента — амило-1,4→1,6-трансгликози- лазы. Расщепление же гликогена требует соответственно разрушения точек ветвления, которое происходит после деградации длинных неразветвленных концов полисахарида, предшествующих точкам ветвления. Это сопровождается гидролитическим отщеплением глюкозных единиц, катализируемым амило-1,6-глюкозидазой. Сами эти ферменты также, вероятно, представляют объект регуляции.
Дополнение 11-Д
Генетические нарушения метаболизма гликогена
В 1951 г. Мак-Ардле описал больного, у которого после небольшой нагрузки появлялись сильные боли и слабость в мышцах. Было обнаружено, что у этого человека полностью отсутствует мышечная гликогенфосфорилаза. С тех пор было описано более 20 случаев этого заболевания. Оказалось, что это одна из нескольких болезней, которые получили общее название болезней накопления гликогена. Как это ни парадоксально, но это заболевание не столь уже серьезно, как это могло бы показаться. Оказалось, что если исключить интенсивные нагрузки и принять еще кое-какие меры предосторожности, то больной может переносить умеренные нагрузки без особого труда. Вплоть до открытия Мак-Ардле считалось, что гликоген синтезируется в результате обращения фосфорилазной реакции. Никаких намеков на UDPG-метаболический путь не было. Поэтому факт накопления гликогена в мышцах у больных был непонятен. Однако после того, как Лелуар (приблизительно в это же время) открыл UDPG, причины этого заболевания стали ясны.
Ряд других, довольно редко встречающихся наследственных заболеваний также вызван накоплением гликогена, которое обусловлено по существу той же причиной, а именно сильным ингибированием процесса расщепления гликогена в гликолитическом метаболизме, что в свою очередь связано с недостаточной активностью какого-нибудь из ферментов: фосфофруктокиназы, киназы фосфорилазы печени, фосфорилазы печени или глюкозо-6-фосфатазы печени. В последнем случае накопление гликогена объясняется тем, что его запасы не поступают из печени в кровь в виде свободной глюкозы. При одном из таких заболеваний имеет место нехватка ветвящего фермента, участвующего в синтезе гликогена, в результате чего образующийся гликоген содержит необычно длинные неразветвленные ветви. Другая же форма заболевания связана с недостатком фермента, ответственного за расщепление гликогена в точках ветвления, в результате чего легко из печени может удаляться лишь ограниченное количество глюкозы, образующейся в результате расщепления только наружных неразветвленных ветвей гликогена.
Наиболее серьезная форма заболевания, обусловленного накоплением гликогена в печени, не связана с нехваткой ферментов, о которых шла речь выше. Болезнь Помпе представляет собой заболевание, сопровождающееся фатальным накоплением гликогена в организме, причиной которого, как оказалось, является нехватка лизосомной а-1,4-глюкозидазы. Это наблюдение указывает на то, что очень важную роль должен играть, по-видимому, совсем другой путь расщепления гликогена до свободной глюкозы в лизосомах.
Было сообщено о нескольких случаях заболеваний, обусловленных нехваткой гликогенсинтетазы. В мышцах и в печени таких больных отмечается недостаток или полное отсутствие запасов гликогена. Для предотвращения гипогликемии необходимо, чтобы больные принимали пищу через строго определенные интервалы.