Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Биосинтез; как образуются новые молекулы
Поликетиды
В 1907 г. Колли (J. N. Collie) высказал предположение, что полимеры кетена (СН2 = С = О) являются предшественниками орселлиновой кислоты — распространенного компонента различных лишайников. Эта гипотеза была модернизирована в 1953 г., когда Бёрч и Донован (Birch, Donovan) сделали допущение о конденсации нескольких молекул ацетил-СоА [уравнение (12-25)], но без последующих двух восстановительных реакций, обязательных при биосинтезе жирных кислот (рис. 11-2) [73]. По-видимому, в процессе конденсации участвуют малонил-СоА и ацилпереносящая группа фермента [74]. В ходе процесса синтезируется ß-поликетон, вступающий в ряд реакций с образованием соединений, относящихся к поликетидам.
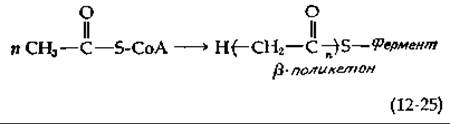
Возможна стабилизация структуры ß-поликетонов путем циклизации в ходе реакции этерификации или альдольной конденсации. После образования циклической структуры оставшиеся карбонильные группы подвергаются восстановлению в гидроксильные; при отщеплении последних в виде молекул воды образуются бензольные или другие ароматические кольца. На рис. 12-9 показаны два пути образования циклических структур. Первый путь включает эфирную конденсацию Клайзена, в ходе которой происходит высвобождение фермента и его SH-группы. Последующая енолизация продукта реакции приводит к образованию триоксиацетофенона. Второй путь формирования циклической структуры — это реакция альдольной конденсации. Продукт конденсации подвергается затем последовательно дегидратации, гидролизу и енолизации, в результате чего образуется орселлиновая кислота. В грибах содержится также 6-метилсалициловая кислота, которая отличается от орселлиновой отсутствием одной ОН-группы. Чтобы представить себе ход биосинтеза 6-метилсалициловой кислоты, достаточно допустить, что на каком-то этапе процесса карбонильная группа у 5-го атома углерода исходного ß-поликетона восстанавливается в гидроксильную; последующее отщепление двух молекул воды и енолизация оставшегося карбонила приведут к образованию указанного продукта (рис. 12-9).
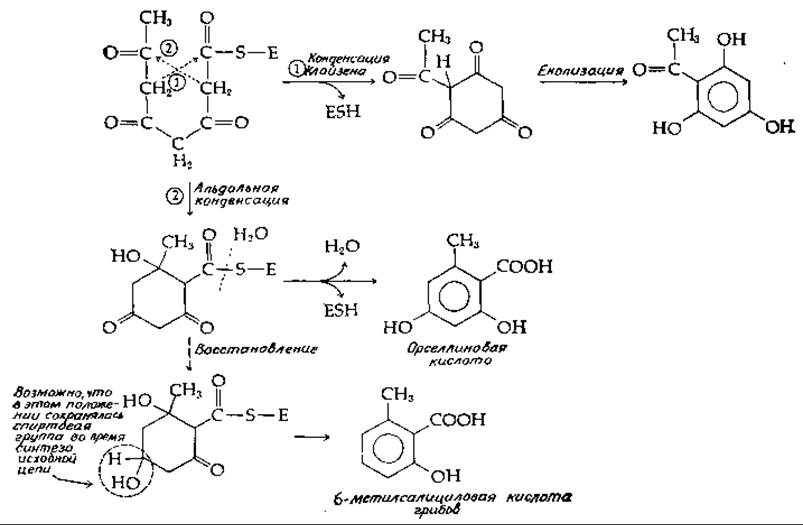
РИС. 12-9. Предполагаемый механизм синтеза орселлиновой кислоты и других полякетидов.
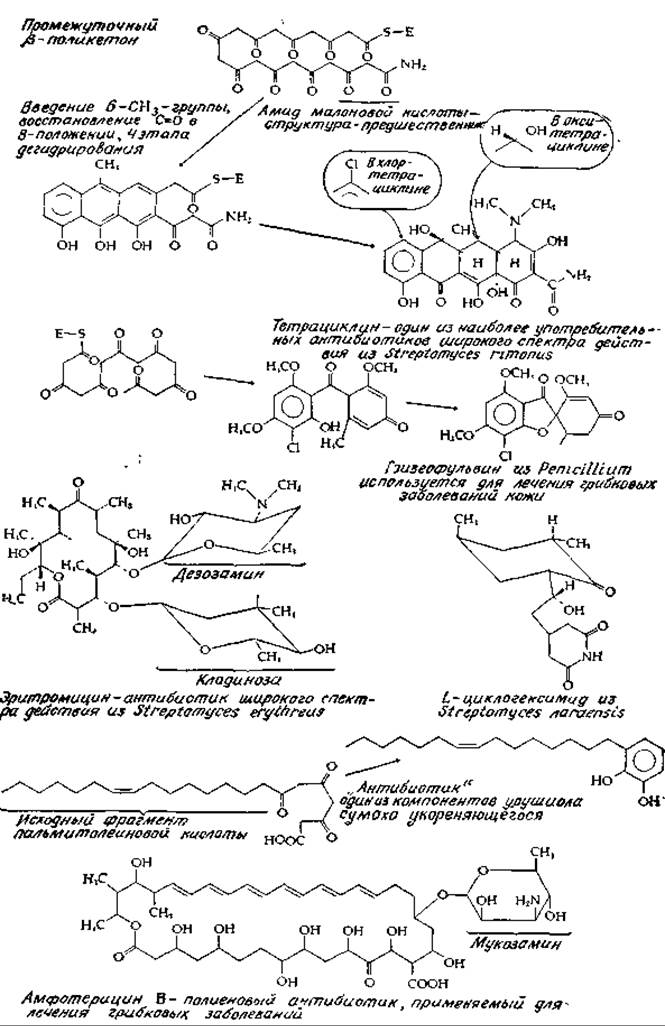
РИС. 12-10. Важнейшие антибиотики поликетидной природы.
На основе небольшого числа изменений исходной поликетоновой структуры возможен биосинтез многих необычных соединений [74]. Так, в некоторых случаях путем гидроксилирования происходит введение дополнительных атомов кислорода; возможен перенос метальных групп от S-аденозилметионина с образованием метоксильных групп; в отдельных случаях метальная группа присоединяется непосредственно к углеродной цепи. Помимо ацетил-СоА в качестве исходных структур синтеза поликетидов могут выступать как жирные кислоты с разветвленной цепью, образованные из валина, лейцина и изолейцина, так и никотиновая и бензойная кислоты. Исходной структурой биосинтеза антибиотика тетрациклина служит, по-видимому, амидмалоновой кислоты в виде СоА-производного (рис. 12-10). На рис. 12-10 показано образование из поликетидов других важных антибиотиков.