Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Регуляция ферментативной активности
Гормоны
Важным элементом контроля метаболизма является связывание гормонов рецепторами, расположенными на поверхности клетки. В некоторых случаях весь эффект действия гормона (например, глюкагона или адренокортикотропного гормона) можно объяснить активацией фермента аденилатциклазы (стадия а на приведенной ниже схеме):
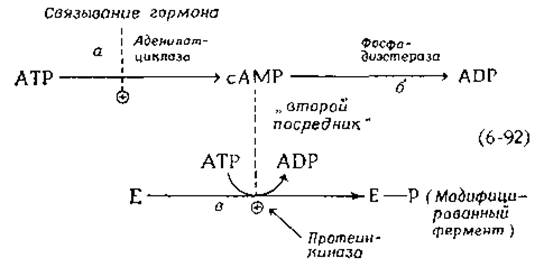
Этот фермент катализирует превращение АТР в циклический АМР (циклический аденозинмонофосфат, или сАМР). Химические аспекты этой реакции обсуждаются в гл. 7, разд. Д, 8. Циклический АМР иногда называют «вторым посредником» («second messenger»), поскольку он переносит сообщение (message), доставленное клетке «первым посредником» (гормоном). Циклический АМР быстро гидролизуется до АМР фосфодиэстеразой (стадия б на схеме; см. также гл. 7, разд. Д, 8). Однако пока сАМР существует, он действует как аллостерический эффектор по отношению к протеинкиназам (стадия в на схеме), которые катализируют такие реакции модификации, как фосфорилирование гликогенсинтетазы (см. предыдущий раздел, а также гл. 11, разд. Е, 3).
1) К рассмотренным типам аллостерической регуляции активности ключевых ферментов под действием клеточных метаболитов следует добавить такой важный тип регуляции, как регуляция соединениями, являющимися индикаторами энергетического состояния клетки (неорганический фосфат, пирофосфат, адеинновые или другие пуриновые нуклеотиды); этот тип регуляции характерен для путей расщепления, а также для амфиболических путей, в ходе которых могут осуществляться процессы и биосинтеза, и расщепления.—Прим. перев.
Характерным представителем этой группы ферментов является растворимая сАМР-зависимая протеинкиназа, обладающая широкой субстратной специфичностью. Фермент, выделенный из мышц, представляет собой димер а2ß2. Две его каталитические субъединицы остаются неактивными до тех пор, пока не произойдет присоединения сАМР к регуляторным субъединицам. Связывание сАМР приводит к диссоциации комплекса на активные каталитические мономеры и содержащую сАМР регуляторную субъединицу, состоящую из двух мономеров [73а, 73Ь].
В 1956 г. Э. Сазерленд установил, что сАМР — это соединение, опосредующее действие гормонов адреналина и глюкагона на гликогенфосфорилазу. На протяжении многих лет большинство биохимиков смотрели на сАМР как на некую диковинку, а на химический механизм регуляции фосфорилазы — как на нечто исключительное. В последнее время, однако, взгляды на этот вопрос резко изменились, поскольку было показано, что сАМР опосредует действие более чем двадцати различных гормонов. Циклический АМР опосредует также, по-видимому, действие нейромедиаторов, высвобождающихся в синапсах. Даже Е. coli продуцирует сАМР, который действует как положительный эффектор при инициации транскрипции определенных генов (гл. 15, разд. Б, 2). В 1971 г. Сазерленду была присуждена Нобелевская премия за успешное развитие этой области исследований [74, 75].
В то время как у высших организмов сАМР функционирует главным образом внутри клеток, у слизевика Dictyostelium discoideum он передает информацию от клетки к клетке (гл. 1, разд. Г, 1). Заслуживает внимания то обстоятельство, что механизм снижения уровня сАМР остается прежним, он основан на участии фосфодиэстеразы [76]. Продуцирование сАМР носит колебательный характер, что связано с существованием механизма автокаталитического контроля, включающего активацию аденилатциклазы (под действием 5'-АМР) и гидролазы (под действием сАМР), катализирующей прямое расщепление АТР до 5'-АМР [77].
Известно, что аденилатциклаза связана с внутренней поверхностью мембран, и тем не менее ее активность существенно изменяется при взаимодействии гормонов с рецепторами, расположенными на внешней поверхности мембран (гл. 5, разд. В, 5). Механизм передачи химического сигнала через мембрану остается пока неясным. Отметим один интересный факт: токсин белковой природы из Vibrio cholerae вызывает диарею и потерю солей организмом, характерные для азиатской холеры, стимулируя аденилатциклазу в клетках эпителия тонкого кишечника [78, 79].
Функции, выполняемые сАМР в клетках, весьма разнообразны. Аллостерическая активация протеинкиназ влияет на целый ряд ферментов, связанных с энергетическим обменом. Фосфорилированию подвергаются не только гистоны — белки клеточного ядра, но и белки мембран [79а], микроканальцев и рибосом [79b] (гл. 15, разд. И, 2). В клетках с различной специализацией один и тот же механизм может привести к совершенно разным эффектам; ниже мы рассмотрим несколько конкретных примеров такого рода.
Многие ферменты, которые модифицируются протеинкиназами, нуждаются в ионах кальция. Поэтому для полного проявления активности аденилатциклазы необходимо также высвобождение ионов Са2+ в цитоплазму, которое обычно инициируется нервным импульсом. Увеличение поглощения ионов Са2+ наблюдается, например, при связывании конканавалина А Т-лимфоцитами (гл. 5, разд. В, 3) [80]. Контроль за поступлением ионов Са2+ в клетки, по-видимому, играет большую роль в осуществлении межклеточных коммуникаций.
В настоящее время интенсивно обсуждается вопрос о возможном превращении гуанозинтрифосфата (GTP) в циклический GMP (cGMP), способный выступать в роли антагониста сАМР во многих процессах контроля метаболизма [81—83]. Однако циклический GMP и другие циклические нуклеотиды присутствуют в гораздо меньших количествах, чем сАМР. Следует также учесть, что GTP совершенно необходим как дополнительный аллостерический активатор, обеспечивающий достаточно высокую чувствительность аденилатциклазы клеток печени к глюкагону [84].
Отметим, что хотя специфичные для инсулина рецепторы идентифицированы (гл. 5, разд. В, 5), механизм действия гормона на метаболизм остается невыясненным. Основное влияние его на обмен углеводов состоит, по-видимому, в регуляции скорости поступления в клетку глюкозы [85]. Предполагается, что при этом роль посредника выполняет циклический GMP.
Механизм действия стероидных гормонов совершенно иной. Эти молекулы поступают в клетки и связываются со специфическими белками — рецепторами, находящимися в цитозоле [86—88]. Комплексы гормонов с белками перемещаются затем в ядро, где, по-видимому, вызывают изменение активности генов, регулируя процессы транскрипции пли трансляции (рис. 6-15).