Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Реакции нуклеофильного замещения (реакция типа 1)
Реакции нуклеофильного замещения у насыщенных атомов углерода
Нуклеофильная атака метальной или другой алкильной группы протекает легко только в том случае, если атом углерода присоединен к какому-либо атому, несущему положительный заряд, например
![]()
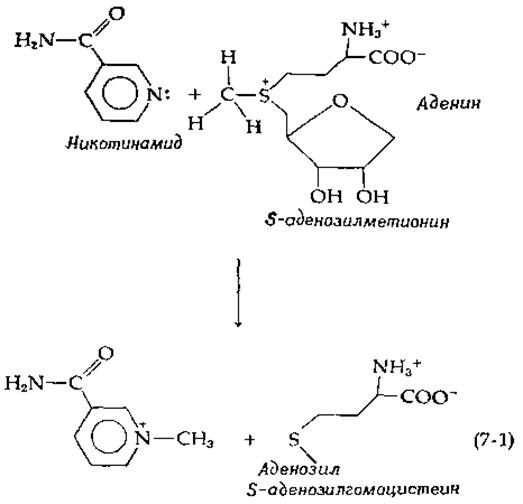
Реакция замещения у сульфоний-иона приводит к переносу метальной группы от атома серы к атакующему нуклеофилу и называется реакцией трансметилирования. Трансметилирование — важный метаболический процесс, в котором роль донора метильной группы обычно выполняет S-аденозилметионин. Типичным примером этого процесса может служить метилирование аминов, например никотинамида [уравнение (7-1)).
К реакциям, близким трансметилированию, можно отнести реакцию неферментативного расщепления тиамина бисульфитом (дополнение 8-Г), реакцию переноса метильной группы от производных фолиевой кислоты [реакция (8-85)] и реакцию, с помощью которой осуществляется синтез S-аденозилметионина [реакция (11-3)].
Еще один пример замещения у насыщенного атома углерода — реакции, катализируемые галоидацетат—галогенидгидролазами почвенных псевдомонад [6], например
![]()
Даже такая плохая уходящая группа, как F-, может быть замещена ионом ОН-.
а. Инверсия как критерий механизма
Интересный результат был получен, когда в качестве субстрата в реакциях, катализируемых галогенидгидролазами, было использовано соединение с хиральным центром у замещенного атома углерода [6]. Реакция L-2-хлорпропионата с гидроксильным ионом приводила к образованию только D-лактата — соединения с конфигурацией, противоположной конфигурации исходного соединения. Объяснить это явление, по-видимому, можно тем, что гидроксильная группа атакует центральный атом углерода со стороны, противоположной той, где находится атом хлора:
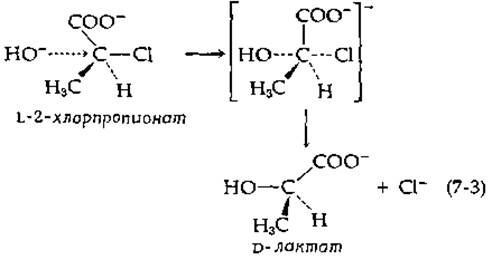
Образующееся пятиковалентное переходное состояние (в центре) отдает хлорид-ион с образованием D-лактата, в котором произошла инверсия конфигурации. Инверсия всегда сопутствует реакциям одноактного замещения, в которых разрыв и образование связи происходят синхронно, как это показано в уравнении (7-3). Однако наличие инверсии не исключает того, что процесс протекает более сложным путем.
б. Реакции замещения у гликозидов
Одинарная связь С—О менее поляризована, чем связь С—S+ у S-аденозилметионина, поэтому простые эфиры нелегко расщепляются в реакциях замещения. Однако гликозиды, у которых имеется атом углерода, соединенный с двумя атомами кислорода, вступают в реакции замещения, приводящие к фосфоролизу, гидролизу или обмену гликозильной группы. В уравнении (7-4) показана реакция замещения в гликозиде (в остатке глюкозы, находящемся на конце цепи молекулы крахмала) фосфатом, выступающим в роли замещающего агента. Как видно из схемы, связанная с ферментом кислотная группа — ВН+ облегчает реакцию замещения. И в этой реакции вновь мы могли бы предсказать инверсию конфигурации с образованием продукта, обладающего ß-конфигурацией у аномерного атома углерода. В действительности же продукты реакций, катализируемых фосфорилазами, не инвертированы. Так, например, сахарозофосфорилаза из Pseudomonas saccharophilia катализирует реакцию
![]()
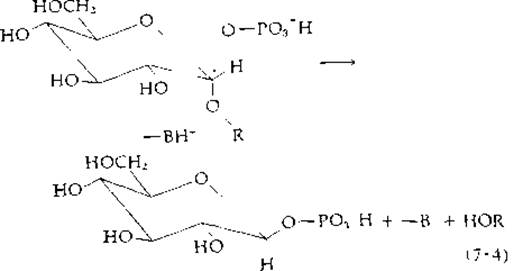
Объяснить такие реакции можно, допустив наличие либо реакции двойного замещения, либо промежуточное образование стабилизированного карбоний-иона.