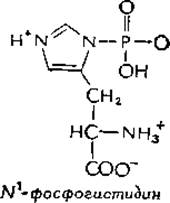
Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
Замещение у атома фосфора
Рибонуклеаза
В 1972 г. Нобелевская премия по химии была присуждена Стэнфорду Муру, Вильяму Г. Стайну и Кристиану Б. Анфинсену за исследования рибонуклеазы — пищеварительного фермента, выделяемого поджелудочной железой, ответственного за расщепление РНК. Стайн и Мур, разработавшие ранее ионообменные методы разделения аминокислот и пептидов, определили аминокислотную последовательность построенного из 124 аминокислотных остатков фермента из поджелудочной железы крупного рогатого скота [57]. Прежде чем были начаты рентгеноструктурные исследования, было установлено, что Lys-41 проявляет необычно высокую реакционноспособность по отношению к динитрофтор-бензолу. Кроме того, на основании данных об инактивации фермента фотоокислением Стейн и Мур пришли к выводу, что два остатка гистидина, His-12 и His-119, локализованные почти на противоположных концах полипептидной цепи, входят в состав активного центра. Результаты кристаллографических исследований показывают, что Lys-41 и два гистидиновых остатка действительно расположены близко друг от друга во впадине, в которой находится активный центр [58].
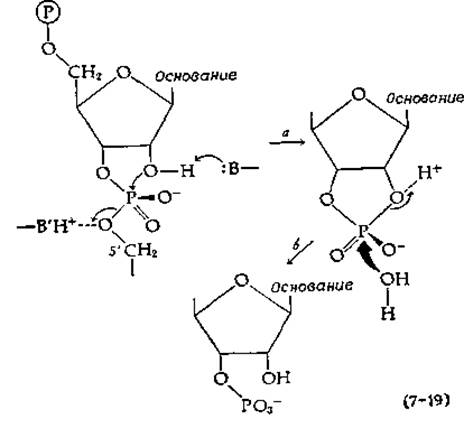
Каталитическое расщепление фосфодиэфирных связей в молекуле РНК под действием рибонуклеазы протекает в две стадии. Расположенная по соседству гидроксильная группа в положении 2' рибозного кольца, по-видимому, депротонируется при атаке основанием В (стадия а в уравнении (7-19).
Образующийся алкоксид-ион атакует затем фосфор, замещая кислород, соединенный с 5'-углеродом соседнего нуклеотидного звена. Последующее расщепление может облегчаться миграцией протона от кислой группы В'Н+. В качестве промежуточного соединения образуется циклический 2',3'-дифосфат, который затем гидролизуется молекулой воды на стадии б с образованием свободного 3'-нуклеотида. Таким образом, суммарная реакция представляет собой процесс двухстадийного двойного, замещения, подобно тому как это имеет место в случае а-химотрипсина, с той разницей, что в роли нуклеофильного катализатора выступает соседняя группа в молекуле субстрата, а не боковая цепь аминокислоты.
Самый ценный вывод, который был сделан на основании данных, полученных методом рентгеноструктурного анализа, состоит в том, что основной группой, отщепляющей протон от 2'-гидроксила, является His-12, в то время как кислотная группа, отдающая протон уходящему 5'-кислороду, принадлежит His-119 [59]. (Любопытно, однако, что синтезированное производное рибонуклеазы с Nт-карбоксиметилированным остатком His-12 проявляет некоторую каталитическую активность — факт, в связи с которым возникает ряд вопросов [60].) Характер зависимости активности рибонуклеазы от pH согласуется с предложенным механизмом, поскольку найдены два значения рKа (5,4 н 6,4), соответствующие двум группам, состояние ионизации которых контролирует активность фермента. (На основании ЯМР-спектров, показанных на рис. 2-42, было получено значение рKа, равное 5,8.) Вблизи двух остатков гистидина расположен остаток Lys-41. Возможно, его положительный заряд используется для частичной нейтрализации отрицательного заряда на атомах кислорода фосфатной группы, облегчая атаку нуклеофильным агентом. С точки зрения химии рибонуклеазы интересен тот факт, что под действием бактериальной пептидазы отщепляется фрагмент, содержащий двадцать аминокислотных остатков. Этот «S-пептид», может воссоединяться с остальной частью молекулы с образованием активного фермента, называемого рибонуклеазой S. Структура этого фермента была определена методом дифракции рентгеновских лучей и по существу оказалась аналогичной структуре нативной рибонуклеазы.
Методы белкового синтеза развиты в настоящее время в такой степени, что ферменты, молекулы которых имеют небольшие размеры, могут быть синтезированы в лабораторных условиях. Это дает возможность создавать новые модифицированные ферменты и критически анализировать роль различных групп активного центра. Так, например, установлено, что построенный из 70 аминокислотных остатков синтетический пептид, аналогичный рибонуклеазе S, но несущий ряд делеций и совершенно не содержащий дисульфидных связей, все же сохраняет заметную каталитическую активность [61].