Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Пептиды в водных растворах
Физико-химические особенности пептидов
Конформации пептидов в растворе
Образование полипептидной цепи — это частный случай полимеризации, в результате которой уменьшается суммарное число степеней свободы мономеров, а за счет этого макромолекула приобретает качественно новые внутримолекулярные степени свободы — конформационные, которые возникают вследствие поворотной изомерии полимерной цепи и отсутствуют у простых молекул.
По мере удлинения пептидной цепи порядок в системе возрастает аналогично тому, как горсть рассыпанных бус приобретает упорядоченность при нанизывании на нитку. При этом вероятность соприкосновения отдельных бусинок друг с другом увеличивается, если нитка будет скручена или свернется. В рамках этой аналогии объединение аминокислот в одну цепную молекулу позволяет их боковым группам сталкиваться и взаимодействовать друг с другом при изгибании и складывании пептидной цепи. Чем длиннее цепь, тем больше набор энергетически доступных конформаций.
Порядок расположения аминокислотных остатков относительно друг друга в молекуле пептида фиксирован, но именно вращение атомов и групп вокруг валентных связей, которое определяется набором возможных торсионных углов, обеспечивает существование множества конформаций пептида. Основная цепь пептида в растворе никогда не имеет простой формы вытянутой нитки. Наиболее вероятная конформация синтетического гомополимера — статистический (беспорядочно спутанный) клубок с максимальным значением конформационной энтропии. Природный пептид имеет более организованную конформацию — его цепь сложена в упорядоченные блоки из-за скручивания и уплотнения пептидной цепочки (Полинг, 1964). Методами рентгеноструктурного анализа было установлено, что полипептидная цепь, состоящая из L-изомеров, изогнута в виде спирали. Один шаг а-спирали вдоль оси пептида составляет 5.4 Å, и на каждый виток спирали приходится приблизительно 3.6 аминокислотных остатка. Каждый из. остатков связан с остатками предыдущего и последующего витков водородными связями между атомом водорода амидной и атомом кислорода карбонильной групп.
На этом уровне молекулярной организации обнаруживается принципиально новое свойство пептидных молекул — способность выделить часть пространства как внутримолекулярную. Эта область внутри а-спиральной структуры недоступна для молекул воды и низкомолекулярных электролитов, тогда как остальная часть пространства, занятая растворителем, электролитами и другими пептидами, может быть названа внешней. Боковые группы аминокислот направлены в сторону внешнего пространства, гидратированы в соответствии со своими гидрофобными свойствами и расположены при максимально плотной упаковке в соответствии со своими удельными объемами (см. табл. 1). Обычные молекулярные модели недостаточно точно представляют конформации пептидных цепей, так как строятся без учета гидратации боковых групп аминокислотных остатков.
Известно, что способность к самоорганизации внутренних полостей проявляют водные растворы амфифильных молекул, например, таких как ионные поверхностно-активные вещества, в том числе фосфолипиды. При определенных концентрациях в водной среде они образуют мицеллы сферических или цилиндрических форм, которые сохраняют внутреннее пространство, недоступное для “внешних” молекул. Но эти коллоидные частицы неустойчивы при изменении pH или ионной силы раствора, так как образующие их молекулы в отличие от звеньев полипептидной цепочки не соединены ковалентными связями. Кроме того, пептидные структуры имеют качественное топологическое отличие: они обладают хиральностью, т. е. они принципиально несовместимы со своим зеркальным отображением.
Не все аминокислотные остатки участвуют в образовании а-спирали: пролин и глицин являются звеньями, которые прерывают спиральную упорядоченность. Локальный разрыв внутримолекулярных водородных связей пептида под действием низкомолекулярных агентов (этанол, мочевина, гуанидин) также способствует разрыхлению спирали. Боковые группы аминокислотных остатков расположены в радиальных направлениях от спирали и поэтому не испытывают пространственных затруднений при вращении около СН2—СН2-связей. Однако физико-химические свойства этих групп (гидрофобность, степень ионизации, окислительно-восстановительный потенциал) определяют характер их взаимодействий между собой. Эти взаимодействия типа притяжения и отталкивания могут быть весьма интенсивными, как стабилизируя спиральную конформацию основной цепи, так и способствуя ее разрушению.
Предпочтительная конформация макромолекулы определяется внутримолекулярными связями боковых групп. Именно эти связи обеспечивают конформационный порядок макромолекулы. Этот порядок уменьшает энтропию цепи, но его энергетическая устойчивость зависит от прочности внутримолекулярных связей боковых групп. Изменение этих связей ведет к конформационным изменениям в цепи. В живых системах все конформационные изменения пептидов обратимы, так как возможность конформационных переходов обеспечивается устойчивостью (прочностью) основной цепи пептида.
Остов полипептидной цепи представляет собой ряд жестких плоскостей с подвижным шарнирным сочленением в позиции асимметрических атомов углерода. При этом дипольные моменты пептидных связей располагаются коллинеарно в направлении от N- к С-концу, их векторы складываются, а структура основной цепи полипептида с гидрофобными боковыми группами становится регулярной. При изменении внешнего электрического поля такой полипептид меняет свою пространственную ориентацию в соответствии с величиной собственного дипольного момента, сохраняя конформацию цепи (Бирштейн, 1975). Обратимые изменения конформации основной цепи происходят, как правило, в полипептидах, имеющих боковые ионогенные гуппы, под влиянием изменения степени ионизации этих групп. В частности, возникновение а-спиральных структур в сополимерах глутаминовой кислоты и лизина зависит от pH внешнего раствора. Расчеты показали, что для этих синтетических сополимеров характерно весьма упорядоченное строение цепи с чередованием типа КЕКЕКЕКЕ или ККЕ-ЕККЕЕККЕЕ (Волькенштейн, Фишман, 1967). Первый вариант структуры можно было бы назвать поливилоном.
Удлинение пептида с заряженными боковыми группами увеличивает диапазон его межмолекулярных взаимодействий за счет расширения диапазона ионизации его боковых групп. Это легко увидеть на примере снижения рКа аминогрупп лизина при переходе от димера к пентамеру (Stewart et al., 1962):
Пептид |
рКа |
Лизин |
8.95 |
Дилизин |
7.56 |
Трилизин |
7.26 |
Тетрализин |
7.15 |
Пентализин |
7.07 |
Аналогичная зависимость наблюдается и у полипептидов с карбоксильными боковыми группами. Иначе говоря, одинаково заряженные соседние ионогенные боковые группы полипептида, как и любого полиэлектролита, имеют повышенное среднее значение рКа (т. е. пониженную среднюю кислотность) и расширенный диапазон степеней ионизации.
Учитывая тот факт, что изменение степени ионизации боковой группы полипептида всегда связано с изменением его локальной гидратации и конформации, можно ожидать, что такой полипептид способен выполнять одновременно и роль молекулярного pH-датчика об окружающей среде, и функцию исполнительного устройства, которое реагирует на изменение pH, изменяя свою гидратацию. Примером такого чувствительного pH-датчика и регулятора гидратации является композиционный сополимер гидрогеля и полипептида, влияющий на скорость поступления лекарственного вещества в клетку (Akala et al., 1998). Живые системы регулируют транспорт метаболитов с не меньшей эффективностью. Ниже (см. раздел 2.2) мы увидим, что мембранный белок, отвечающий за транспорт воды в клетку, работает по тому же принципу.
Существует огромный объем литературы, посвященной принципам структурной организации природных пептидов и белков. Эти работы выполняются методами конформационного анализа, при котором из всего набора доступных конформаций выделяется несколько наиболее доступных и энергетически выгодных. Подробный анализ таких работ представлен Е. М. Поповым (1997). Обобщая результаты литературных данных и собственных оригинальных работ, автор пришел к определенным выводам относительно закономерностей, в соответствии с которыми происходят конформационные изменения в полипептидных цепях. В физиологических условиях пространственное строение природного олигопептида описывается ограниченным набором низкоэнергетических компактных структур, стабильность которых обусловлена согласованностью всех внутримолекулярных невалентных взаимодействий. При изменении внешних условий (растворителя, температуры, кислотности, расстояния до соседней молекулы-рецептора) природный пептид адаптируется к ним смещением своего конформационного состояния. Смещение равновесия между предпочтительными структурами пептида происходит через последовательную смену конформаций с низкими энергиями в форме волны внутримолекулярного возбуждения. Иначе говоря, эта последовательность конформационных изменений также упорядочена, как и аминокислотная последовательность пептидной цепи. Новая конформация характеризуется новым спектром частот собственных колебаний и соответствующим изменением теплоемкости пептидной цепи (Попов, 1997).
Результаты теоретических расчетов для конкретных природных пептидов позволяют выделить в структуре каждого из них структурно жесткие участки, конформация которых меняется с большими энергетическими затратами, и структурно гибкие (лабильные) участки, которые обладают высокой торсионной подвижностью в области физиологических температур. В табл. 3 представлены структуры нескольких регуляторных пептидов, для которых рассчитана жесткость цепей (Попов, 1997). Отметим, что жесткие участки состоят из 4 или из 7 аминокислотных остатков, т. е. кратны числу остатков, приходящихся на один виток а-спирали. Расположение гидрофильных и гидрофобных остатков вдоль цепи также влияет на жесткость этих участков, так как а-спираль позволяет гидрофобным аминокислотным остаткам осуществлять внутримолекулярные связи. Все формулы пептидов, представленные в этой таблице и далее в тексте, соответствуют данным биохимического справочника (Oxford Dictionary..., 1997).
Таблица 3 Жесткость цепей регуляторных пептидов (по: Попов, 1997. С. 404)

Рассматривая взаимосвязь структуры и биологических функций полипептидов, нельзя забывать, что всякая их функция основана на высокой подвижности компонентов живых клеток, а эта подвижность обеспечивается присутствием воды — одного из основных метаболитов. Несмотря на то что рибосомы и макромолекулы белков и нуклеиновых кислот очень плотно упакованы в цитоплазме между органеллами и эндоплазматическим ретикулумом (ЭР), благодаря присутствию воды они совершают конформационные переходы и разнообразные движения, для которых вода является не столько “окружением”, сколько лабрикантом. Гидрофобное микроокружение (например, присутствие соседних гидрофобных поверхностей ЭР или липопротеиновых комплексов) также повышает молекулярную подвижность гидратированного полипептида.
Можно различить три вида внутриклеточных молекулярных движений: 1) вращения макромолекул; 2) перемещения из одной позиции в другую (трансляционные движения); 3) быстрые колебания (вибрации) атомов, составляющих молекулу. Все эти движения важны для того, чтобы молекулярные поверхности пришли в контакт и могли осуществить определенное взаимодействие — выполнить специфическую функцию.
Скорости молекулярных движений исследуются с помощью различных методов спектроскопии. Этими методами установлено, что полипептидные макромолекулы в цитоплазме постоянно меняют конформации, изгибаются, вращаются и сталкиваются с соседями. Частота диффузионных столкновений полипептидов с низкомолекулярными компонентами пропорциональна концентрации диффундирующих молекул. Например, при обычной концентрации АТФ в клетке порядка 1 мМ каждая пептидная цепь подвергается случайным столкновениям с АТФ с частотой 106 в секунду (Alberts et al., 1994). Если иметь в виду, что эти молекулярные взаимодействия и химические реакции происходят в объеме 4∙103 мкм3, т. е. в масштабах, очень далеких от условий лабораторной пробирки, то становится более понятной высокая эффективность энзиматических реакций in vivo. Результатом “удачного” столкновения с центром связывания может быть или образование межмолекулярного комплекса, или ферментный гидролиз. Это зависит от природы центра связывания.
Каталитический центр можно представить как некоторую фрактальную поверхность. Тогда скорость химической реакции (v) при диффузионном лимитировании представляется уравнением
V = k ∙ [А]X,
где [А] — концентрация взаимодействующих структур; k — константа скорости; X — показатель степени, указывающий концентрационный порядок реакции:
X = 1 + 2 /DS,
где Ds — фрактальная размерность каталитического центра (Kopelman, 1992).
В модельной системе молекулы А = IJ случайно сталкиваются с центром связывания и немедленно превращаются в два молекулярных фрагмента I и J. Затем они могут двигаться по поверхности (или поверхность может двигаться под ними), в результате чего происходит рекомбинация фрагментов и возникает продукт IJ, который немедленно диссоциирует от каталитического центра. Самая большая скорость такой реакции достигается, когда центром связывания является не поверхность, а одномерная цепь (Ds — 1, X = 3). В этом случае из-за уменьшения топологических ограничений она может создавать рекомбинации для осуществления реакций с тремя молекулярными столкновениями (Kopelman, 1992).
Эта умозрительная модель находит подтверждение при экспериментальном исследовании взаимосвязи конформации пептидной цепи с ее каталитической функцией. Установлено, что, если определенная конформация пептидной цепи сближает боковые группы с низкой реакционной способностью, эта их способность многократно усиливается именно за счет сближения. Такая конформация пептидной цепи, которая обеспечивает биохимически активное сближение боковых групп пептида, называется нативной.
Например, в пептидной цепи химотрипсина у гистидинового остатка His57 атом азота Nт пространственно сближен с карбоксильной группой остатка аспарагиновой кислоты Asp102, а атом азота Nп — с боковой группой серина Ser195. Карбоксильная группа аспарагина принимает на себя протон от имидазольного кольца, в котором смещается электронная плотность, и атом азота Nп активирует гидроксильную группу серина, отнимая у нее протон, так что она образует ковалентную связь с карбонильной группой другого пептида (субстрата), разрывая тем самым его пептидную связь (Alberts et al., 1994). По этой схеме осуществляют гидролиз пептидной связи все сериновые протеиназы. Амфифильный характер пептидов и определенное чередование в их структуре гидрофильных и гидрофобных боковых групп приводят к дополнительным особенностям конформации пептидов в растворе. Они возникают в соответствии с правилом минимизации свободной энергии поверхности раздела пептида и водного окружения. Эта минимизация достигается пространственным разделением гидрофильных и гидрофобных боковых групп в форме ß-листа или а-спирали (Kaiser, Kеzdy, 1984). Схемы такой сегрегации представлены на рис. 4, А. Особенности а-спиральных структур с характерным расположением гидрофильных и гидрофобных групп на противоположных сторонах а-спирали были обнаружены еще в 1967 г. и с тех пор называются “колесами Эдмундсона”, или спиральными колесами (Schiffer, Edmundson, 1967). В одиночной а-спирали боковые группы первой и четвертой аминокислот располагаются близко друг к другу на внешней цилиндрической поверхности молекулы. Это чередование повторяется с периодом 7 остатков, что соответствует двум оборотам а-спирали. Если в этих положениях находятся аминокислоты с гидрофобными боковыми группами, то образуется гидрофобное “ребро” а-спирали. Гидрофобные взаимодействия вдоль этого ребра дополнительно упрочняют систему водородных связей вдоль основной цепи пептида и общую структуру спирали. Кроме того, если гидрофобные боковые группы пептида попадают “в рифму” 1—4, то в силу особенности гидратации они имеют повышенные парциальные объемы, а гидрофобное ребро в этом случае приобретает более длинный период оборота по сравнению с обычной а-спиральной конформацией. На рис. 4,Б изображена в виде семигранного цилиндра скрученная спираль последовательности 16—32 иммуностимулятора тимопоэтина. Природный тимопоэтин — пептид из 49 аминокислотных остатков (см. табл. III Приложения), содержащий “активный центр” — пептидную последовательность 32—36. Химически синтезированный пентапептид идентичной структуры проявляет активность целой молекулы, за что и был назван тимопентином (табл. 3, строка 2). Предшествующий “активному центру” и следующий за ним участки цепи (16—32 и 37—49 соответственно) могут образовывать спиральные “колеса”.
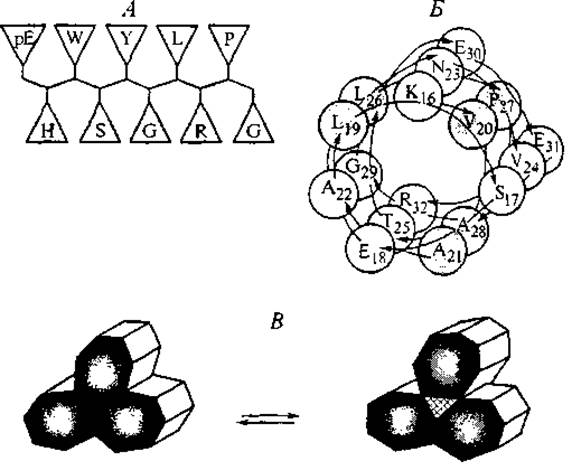
Рис. 4. Схемы ß-листовой структуры гонадолиберина (А) и части скрученной а-спирали (суперспирали) тимопоэтина (Б), демонстрирующие пространственное разделение гидрофильных и гидрофобных (затемненные) аминокислотных остатков. Схема В представляет поперечное сечение жгута ассоциированных суперспиралей и конформационный переход, в результате которого образуется внутренний канал между суперспиралями.
В составе представленного участка в позициях 19 и 26 находятся остатки лейцина. Нужно отметить, что лейцин играет особую роль в формировании и упрочнении спиральных структур. В структурных исследованиях сформировалось представление о “лейциновой застежке” (Leucine zipper — имеется в виду застежка-молния). Она представляет собой сравнительно короткие последовательности со средней длиной 24 аминокислотных остатка, среди которых в позициях 2, 5, 7, 12, 16, 21 и 24 находятся остатки лейцина, формирующие гидрофобные грани спирали. Такие структуры, характерные для трансмембранных участков мембранных белков, участвуют в межмолекулярных взаимодействиях белок—белок и белок—ДНК. В последнем случае конфигурация “лейциновой застежки” определяет контакт пептида с поверхностью двойной спирали ДНК (см. раздел 3.2).
Подобные а-спиральные блоки были обнаружены в цепях некоторых пептидных гормонов: кальцитонина, соматолиберина, кортиколиберина, аполипопротеина А, ß-эндорфина (Kaiser, Kezdi, 1984). Этот принцип чередования аминокислотных остатков вдоль основной цепи был использован при конструировании и химическом синтезе аналогов природных гормонов (соматостатина и глюкагона) с повышенной специфической активностью (Rivier et al., 1978).
Особенностью скрученных а-спиральных участков (суперспиралей) является их способность укладываться несимметричными жгутами, как это показано на рис. 4, В. При этом гидрофобные ребра спиралей могут быть ориентированы внутрь жгута и плотно прилегать друг к другу — это одна конформация. При изменении взаимодействий на гидрофильных ребрах суперспирали гидрофобные ребра меняют ориентацию, а внутренняя часть жгута образует гидрофильный канал (Alberts et al., 1994). В следующей главе мы еще вернемся к пептидным суперспиралям при рассмотрении структур мембранных рецепторов.
Сегрегация гидрофильных и гидрофобных групп на разных гранях семигранной пептидной спирали сообщает молекуле дополнительные функциональные свойства (Zhou et al., 1992). Гидрофобные группы, расположенные на одном ребре семигранника, могут составить опознавательную детерминанту при взаимодействии с другими пептидами, имеющими гидрофобные участки (Immimostimulants, 1987). А гидрофильные, в частности ионогенные, боковые группы, расположенные последовательно по периметру сечения семигранника с определенным чередованием положительно и отрицательно заряженных групп, являются детерминантными участками связывания многих высокомолекулярных антигенов.
Таблица 4 Аминокислотные последовательности детерминантных участков пептидных антигенов (по: Норр, Woods, 1981)
Белковый антиген |
Детермииантный участок пептидной цепи |
Гемагглютинин чумы а-Цепь холеротоксина Энтеротоксин Е. coli N-протеин стрептококков Человеческий интерферон-І Человеческий интерферон-II |
—E—R—R—E—G—D— —E—A—K—V—E—K— —Е—R—М—К—D—Т— —R—К—A—D—L—Е—К— —Е—Е—К—L—Е—К—Е—D— —E—R—L—R—R—K—E— |
В табл. 4 представлены аминокислотные последовательности гидрофильных эпитопов нескольких антигенов (Норр, Woods, 1981). Интересно отметить чередование положительно и отрицательно заряженных боковых групп вдоль этих цепей, что повышает энергетическую выгодность их расположения на общем ребре в свернутой спирали.
Обращает на себя внимание определенное качественное сходство детерминантных участков некоторых микробных антигенов с участками полипептидной цепи тимусных пептидов, отвечающих за иммунитет организма. По локальной плотности положительно и отрицательно заряженных боковых групп и по последовательности их чередования (повторение блоков КЕ и ЕК) эти пептиды очень похожи (см. табл. III Приложения).
Определенное сходство наблюдается между тимопентином и детерминантом гемагглютинина чумы, а также между детерминантом холеротоксина и интерфероном. Можно предполагать, что в результате длительного эволюционного процесса возбудители особо опасных инфекций включили в состав своих антигенных детерминантов (эпитопов) пептидные участки, имитирующие аминокислотные последовательности пептидов иммунной системы человека.
Кроме процессов узнавания в системе “антиген—антитело” определенный порядок чередования положительно и отрицательно заряженных боковых групп очень важен для облегчения трансмембранного переноса полипептидной цепи. При статистическом анализе чередования Lys и Asp, Arg и Glu в структуре ряда секретируемых клеткой белков была обнаружена устойчивая тенденция этих остатков располагаться друг от друга на расстоянии четырех аминокислотных остатков (Heijne, 1980), что создает возможность локальной внутримолекулярной нейтрализации электростатических зарядов при свертывании пептида в амфифильную суперспираль.
Особое свойство амфифильной пептидной суперспирали как матрицы для нерибосомального пептидного синтеза было продемонстрировано в работе Ли с соавторами (Lee et al., 1996). Авторы экспериментально доказали, что скрученная пептидная цепь из 32 аминокислотных остатков с определенной последовательностью, образующая семигранник с двумя гидрофобными ребрами, обладает способностью к автокаталитической саморепликации, т. е. тем свойством макромолекулы, которое до последнего времени было обнаружено только у нуклеиновых кислот. В работе был использован метод автокаталитического синтеза пептидной связи на пептидной матрице. Образование пептидной связи между двумя олигопептидными фрагментами было организовано путем конденсации пептидных тиоэфиров (метод Кента) (Dawson et al., 1994). Реакционная смесь состояла из равных количеств электрофильных и нуклеофильных пептидных фрагментов в присутствии минорного количества целевого пептида — матрицы. Автокаталитический характер использованной реакции был подтвержден линейной зависимостью между начальной концентрацией матричных молекул и скоростью синтеза. Реакция оказалась весьма структурно- и хемоспецифической.
Известно, что реакции поликонденсации пептидных тиоэфиров протекают в клетках бактерий и низших эукариот при синтезе пептидов (в частности, пептидных антибиотиков) с участием специфических пептидных синтетаз. Подобный нерибосомальный синтез олигопептидов считается самым эволюционно древним способом пептидной самозащиты, поскольку такие пептиды содержат некодируемые D-аминокислоты и проявляют повышенное сродство к фосфолипидным структурам клеточных мембран. Именно эти свойства позволяют им активно участвовать в нарушении мембранной проницаемости и проявлять антибиотический эффект по отношению к клеткам-конкурентам (Biotechnology of antibiotics, 1997).
В физиологических условиях конформации отдельных участков пептидной цепи могут меняться в результате подвижности боковых групп в пространстве при сохранении неизменного порядка вдоль цепи, однако эти изменения обратимы. Как показывают спектроскопические методы, каждая конформация имеет набор собственных характеристических колебаний. При возникновении нефизиологических условий конформация достаточно длинного полипептида может измениться до статистического клубка — без разрыва пептидных связей, но с потерей биологической активности. Этот конформационный переход называется денатурацией. При этом спектральные характеристики макромолекулы теряют определенность, а конформационная энтропия клубка достигает максимума.
В ряде случаев возвращение к физиологическим условиям позволяет полипептиду снова вернуться к нативной конформации, особенно если она стабилизирована внутрицепными S—S-связями. Однако такая ренатурация возможна только для одноцепочечных пептидов. Например, молекула инсулина, состоящая из двух пептидных цепей, связанных S—S-мостиками, после разрушения этих мостиков и денатурации не может вернуться к нативной конформации. Это определяется особенностями синтеза инсулина. Нативная конформация инсулина возникает в результате гидролиза проинсулина. Как показано на рис. 5, проинсулин синтезируется как одна пептидная цепь, содержащая на концах два участка: А- и В-цепи будущего инсулина с шестью свободными цистеиновыми группами в их составе. Средний участок проинсулина (С; см. рис. 5) принимает такую конформацию, при которой устанавливается определенная система S—S-связей между концевыми участками цепи. После выщепления среднего участка возникает активная двухцепочечная молекула инсулина. Именно по причине пространственной предопределенности этой структуры за счет среднего участка проинсулина спонтанная ренатурация инсулина невозможна. Иными словами, удаление части пептидной цепи равнозначно потере молекулярной информации для оставшихся частей инсулина.
В последнее время интенсивно проводятся исследования посттрансляционной модификации пептидов, в ходе которой с высокой селективностью осуществляется синтез пептидной связи, предопределенный конформацией соединяемых олигопептидов. Эта модификация включает два согласованных протеолитических расщепления пептида и последующее соединение концов двух полученных фрагментов. Примером такой комбинаторики является соединение и циклизация двух усеченных цепей при биосинтезе макроциклического пептидного антибиотика θ-дефенсина, продуцируемого моноцитами и нейтрофилами (Tang et al., 1999). Такие процессы рассматриваются как пептидный сплайсинг (связывание концов), который происходит аналогично сплайсингу РНК (Cooper, Stevens, 1995).
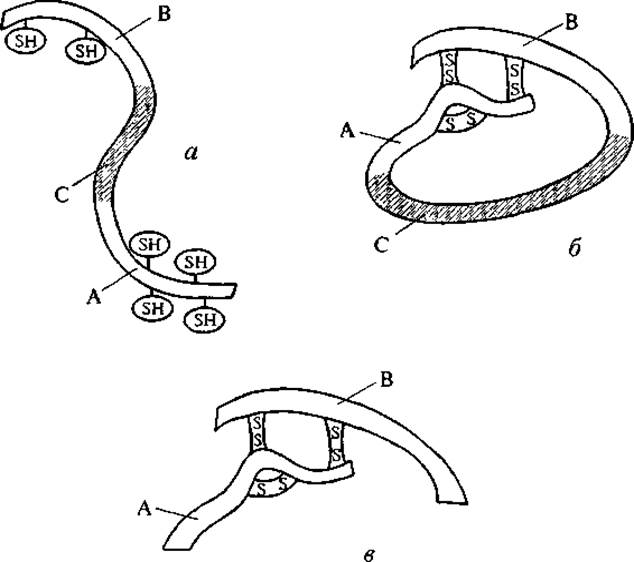
Рис. 5. Формирование молекулы инсулина из проинсулина. а — строение пептидной цепи проинсулина: А и В — концевые участки, С — средний участок; б — конформационное изменение проинсулина, приводящее к внутримолекулярной S—S-сшивке его концевых участков; в — строение нативной молекулы инсулина.
Компактная конформация полипептида, закрепленная внутримолекулярными гидрофобными связями, определяет топографию расположения гидрофильных и гидрофобных боковых групп на поверхности макромолекулы, ее мозаичную структуру. Взаимное расположение заряженных боковых групп аминокислотных остатков на поверхности пептидной глобулы неоднородно: имеются области с разными по величине и знаку зарядами, что может быть отображено на карте электростатического потенциала поверхности.
Прямые вычисления этого потенциала по данным рентгеноструктурного анализа для ряда полипептидов и нуклеиновых кислот показали не только пространственную комплементарность, но и комплементарность электростанического потенциала поверхности (ЭПП) центров связывания ферментов с субстратами, антител с антигенами, ферментов с ингибиторами (Wainer et al., 1982). На примерах комплементарности ЭПП рибонуклеазы и РНК, трипсина и его ингибитора, тироксина и преальбумина показано, что участки этих молекул, не занятые в электростатическом притяжении лигандов и центров связывания, обеспечивают взаимное локальное отталкивание участников взаимодействия (в том числе и под действием электростатического отталкивания одноименных зарядов), так что энергетические барьеры для обратной реакции диссоциации комплекса не очень высоки. Иначе говоря, межмолекулярная комплементарность не смешает равновесие взаимодействия пептидов только в сторону связывания — соседние участки пептидной цепи обеспечивают обратимость этого процесса и диссоциацию комплекса. Такие подвижные равновесия лежат в основе межмолекулярной ассоциации биологически активных полипептидов как при энзиматическом катализе, так и при пептидной регуляции определенных функций клетки.
Электростатическая комплементарность взаимодействующих пептидов, не уравновешенная силами отталкивания, приводит к необратимым фазовым превращениям. Примером таких превращений служит спонтанная и необратимая самоассоциация пептидов, состоящих из чередующихся тетрапептидных блоков, комплементарных друг другу по знаку заряда:
(Ala—Glu—Ala— Glu—Ala—Lys—Ala—Lys—)2.
В водных растворах эти пептиды образуют межмолекулярные ассоциаты со структурой ß-листа и в присутствии солей выпадают в виде макроскопических мембран и волокон (Zhang et al., 1993). При комплексообразовании резко снижается гидратация пептидов. Электронная микроскопия позволяет увидеть их микроструктуру: переплетенные филаменты толщиной 10—20 нм. Они ни в чем не растворяются — ни в кислотах, ни в щелочах, ни при добавлении мочевины или гуанидина, ни под действием протеолитических ферментов. Есть все основания предполагать, что такого типа межмолекулярная ассоциация пептидов лежит в основе формирования амилоидозных отложений в различных тканях (Tomas et al., 1996). В частности, сывороточный белок — амилоид А с молекулярной массой 13.4 кДа продуцируется печенью под действием цитокинов и откладывается в виде самоассоциатов в различных органах и тканях, повреждая их и вызывая амилоидоз; ß-амилоидный глико-протеин с молекулярной массой 86.8 кДа откладывается главным образом в нервной ткани и является одной из причин заболевание Альцгеймера. Аналогичные поражения мозга вызывают прионы — мембранные белки с молекулярной массой 33—35 кДа, которые, по-видимому, после потери гликофосфолипидной составляющей теряют нативную а-спиральную структуру и приобретают структуру ß-листа. Во всех перечисленных примерах причиной амилоидозных отложений является необратимая, электростатически закрепленная самоассоциация комплементарных участков пептидных цепей, имеющих ß-конфигурацию.
Значительные изменения конформаций полипептидов наблюдаются при энзиматической модификации их боковых групп: при метилировании, декарбоксилировании, деамидировании. Наибольшие изменения гидрофильности и конформации полипептидов происходят при фосфорилировании боковых групп серина, треонина или тирозина (под действием фосфокиназ) или при гликозилировании полипептида. Эти процессы относятся к другой области саморегуляции организма — к области согласованных ферментных систем, обеспечивающих метаболизм и взаимосвязь пептидов с другими классами молекул: с углеводами, полифосфатами и липидами.
Как уже упоминалось, все конформационные переходы и межмолекулярные взаимодействия в живых системах происходят в водном окружении, хотя эта вода организована в форму гидратационных оболочек (связанная вода) макромолекулы.
Очевидно, что изменение конформации пептида сопровождается изменением его гидратационных оболочек и системы водородных связей, которая в гидратационной воде имеет вполне определенную динамическую структуру. Боковые группы пептида расположены таким образом, что их водородные связи с другими группами легко меняют ориентацию и преобразуются в водородные связи с молекулами воды ближайшего окружения. Частота смены “партнеров по водородным связям” зависит от химической природы боковой группы и от ее расположения в данной конформации пептида.
Причиной изменения конформации пептидной цепи могут быть не только ее межмолекулярные взаимодействия, но и изменения внутримолекулярных электростатических характеристик молекулы, связанные с изменением степени ионизации ее боковых групп. Ориентация вектора локального диполя (от центра тяжести отрицательного заряда к центру тяжести положительного) меняется по мере деионизации боковых групп (см. рис. 3) при изменении диэлектрической проницаемости или pH внешней среды. Результирующее изменение электростатической составляющей свободной энергии, как правило, приводит к изменению конформации всей молекулы. Поскольку каждая конформация представляет собой упорядоченную структуру, изменение конформации сопряжено с изменением порядка не только в структуре пептида, но и в координированной системе Н-связей водного окружения (см. рис. 4, В — переход а-спиральных конформаций в суперспираль). На фоне тепловых флуктуаций эти упорядоченные изменения воспринимаются объемной (свободной) водой не как возмущения, а как упорядоченные молекулярные сигналы об изменении конформации пептида. В этом качестве они могут транслироваться через водную среду к другим макромолекулам и клеточным рецепторам.
Предлагаемая упрощенная модель информационного дальнодействия подчеркивает только одну особенность молекулярных сигналов: их трансляция не связана с передачей массы или энергии. Она основана на чередовании обратимых конформационных переходов нативного пептида и связанной с ним воды. Для трансляции сигналов пептида о собственном конформационном состоянии не требуется специального кода, так как они исходно возникают в форме локального изменения и смещения системы водородных связей воды и в этой же форме транслируются и воспринимаются.
Решение конкретной задачи — какая форма сигнала характерна для данного пептида и какую реакцию этот сигнал может вызвать в пептиде-реципиенте — требует предварительного систематического сравнения аминокислотных последовательностей пептидов, выполняющих определенные регуляторные (информационные) функции. Как правило, их активность проявляется на уровне специализированных функциональных систем организма и часто определяется как тканеспецифическая. Этот вопрос мы рассмотрим детальнее в следующем разделе.