Пептидная саморегуляция живых систем (факты и гипотезы) - Шатаева Л. К. 2003
Пептиды в водных растворах
Тканеспецифические регуляторные пептиды
Нейропептиды
Нервная система позвоночных сочетает несколько функций: контроль за состоянием физиологических параметров внутри организма и за состоянием параметров внешней среды, передача полученной информации в центральную нервную систему, интегрирование информации и ее сравнение с данными, которые сохраняются в памяти, передача командных сигналов исполнительным органам всех систем организма и контроль за исполнением этих команд. Иными словами, нервная система имеет прямые регуляторные функции, которые определяются потоками информации о состоянии внешней и внутренней среды.
Нервная система человека состоит из нервных клеток — нейронов, соединенных между собой системой синапсов. В головном мозге человека содержится приблизительно 1011 нейронов, и каждый из них в норме соединен посредством синапсов с сотнями и тысячами других. Помимо нейронов в мозге человека содержится соединительная ткань — клетки глии различных типов; причем их количество в 5—10 раз превышает количество нейронов: нейроглия составляет примерно 40 % объема головного и спинного мозга человека. Интегрирующая и командная информационные сети головного мозга снабжены несколькими эндокринными железами, которые синтезируют пептидные гормоны.
Классическая номенклатура эндокринных желез включает в себя гипофиз, эпифиз, гипоталамус, щитовидную и паращитовидную железы, поджелудочную железу, надпочечники и гонады (Панков, 1996). Исторически сложилось так, что регуляторы, выделенные из этих желез, были названы гормонами, среди них есть и высокомолекулярные белки, и небелковые соединения. Позднее обширную группу пептидов, выделенных из нейроэндокринных желез, стали называть нейропептидами (НП). В настоящее время это наиболее изученные регуляторные пептиды.
Предложенная И. П. Ашмариным (Ашмарин, Каменская, 1988) классификация пептидов включает в себя пептиды только нейронного происхождения. Придерживаясь этого правила и учитывая особенности тех тканей, из которых пептид выделен, в табл. I Приложения представлены наиболее простые регуляторные НП (Regulatory peptides, 1989; Ашмарин, Каразеева, 1999).
Многие НП и пептидные гормоны образуются из высокомолекулярных предшественников (например, протахокинина, проопиомеланокортина, хромогранинов и др.), синтез которых закодирован в соответствующих генах. В частности, хромогранин А, предшественник нескольких статинов, встречается во всех нейроэндокринных тканях и секретируется из панкреатических и тироидных С-клеток одновременно с другими гормонами. В его структуре содержатся блоки из двух аминокислотных остатков со щелочными боковыми группами (R— R, R—К, К—R и К—К), которые специфически гидролизуются внутриклеточными эндопептидазами. В результате образуются собственно регуляторные НП: парастатин, панкреастатин и вазостатин, которые ингибируют выделение катехоламинов, а вазостатин, кроме того, снижает сосудистое давление. Другие РП, получаемые в результате специфического гидролиза протахокинина и проопиомеланокортина, до особого сигнала сохраняются упакованными в нейросекреторных гранулах в пресинаптических окончаний нейронов. Процесе их выделения осуществляется, по-видимому, в форме обычного экзоцитоза после получения электросекреторного или химического сигнала с внешней стороны мембраны, в частности от мембранного рецептора.
Представленные в табл. 1 Приложения структуры НП различаются молекулярными размерами: число аминокислотных остатков в молекуле меняется от 3 (тиролиберин) до 44 (соматолиберин). В работе И. П. Ашмарина и М. А. Каменской (1988) представлены данные о продолжительности существования НП в плазме и спинномозговой жидкости, которые показывают, что малые пептиды из 3—8 аминокислотных остатков имеют время полураспада 1—2 мин, хотя тиролиберин в различных тканях остается активным до 1 ч. Более длинные пептиды сохраняют эффективность в течение нескольких часов.
На устойчивость пептида в клеточной среде влияет в первую очередь природа первой, N-концевой, аминокислоты. Метионин, аланин, серин, треонин, валин, глицин, цистеин и пролин защищают пептиды от гидролиза. Остальные 12 аминокислот, оказавшись на N-конце, вызывают протеолитическую атаку (Alberts et al., 1994). Таким образом, НП проявляют более продолжительное действие по сравнению с обычными нейромедиаторами (ацетилхолином, гистамином, серотонином и ГАМК), которые активны в течение 10-2— 1 с. В ряде случаев пептиды, выделенные во внешнюю гуморальную среду (кровь, лимфу, тканевую жидкость), подвергаются гидролизу под действием пептидаз. Примером может служить каскадный гидролиз (рис. 6, А) предшественника брадикинина сериновыми протеиназами семейства калликреинов (Марголис, Бьюсе, 1983).
Сравнение структур эндорфина и энкефалинов позволяет предположить, что аналогичный поэтапный гидролиз осуществляется и в группе опиоидов.
Структурную взаимосвязь между различными НП, происходящими от одного предшественника, можно проследить на примере гормонов гипофиза. Часть из них содержит одинаковое гептапептидное ядро, которое обведено рамкой в аминокислотной последовательности а-меланотропина — меланоцитстимулирующего гормона (рис. 6, Б).
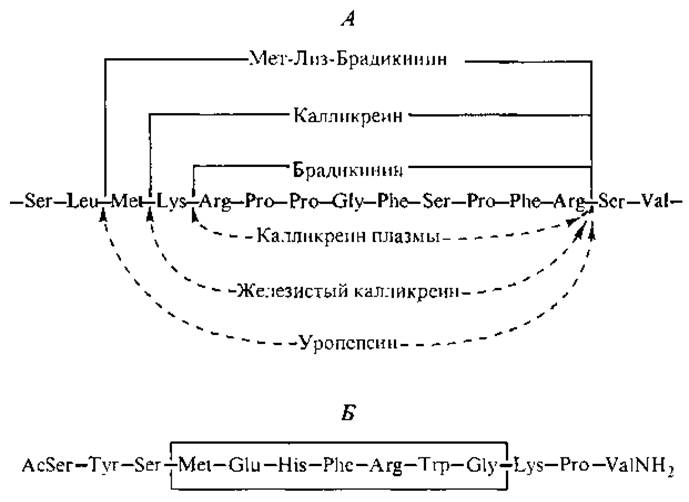
Рис. 6. Последовательный протеолиз участка цепи плазменного глобулина кининогена специфическими гидролазами (А) и аминокислотная последовательность а-меланотропина (Б).
В кортикотропине (АКТГ) присутствует не только указанный гептапептид, но и целиком вся последовательность аминокислот а-меланотропина (сравним две последние строчки в табл. I Приложения). Такое же ядро обнаруживается в гипофизарных ß- и у-липотропинах (91 и 56 аминокислотных остатков соответственно), которые стимулируют реакции гидролиза липидов в жировых тканях. Эти гормоны, как и АКТГ, относятся к семейству гипофизарных гормонов, предшественником которых является проопиомеланокортин — прогормон из 241 аминокислотного остатка. Фактически липотропная активность собственно липотропинов не выше, чем у АКТГ и меланотропина, и до сих пор неясно, имеют ли они какую-либо собственную специфическую физиологическую активность, но оба липотропина присутствуют в плазме людей.
Данные о полифункциональности кортикотропина дополняются информацией о том, что пептидные участки его цепи 4—7 и 4—10 стимулируют внимание и обучение (Пономарева-Степная и др., 1984), а синтетический пептид Семаке, созданный на основе последовательности АКТГ (4— 10) путем замены последних трех аминокислот для защиты от ферментного гидролиза, является стимулятором обучения пролонгированного действия и рекомендован для клинического применения (Гомазков, 1997):
Met—Glu—His—Phe—Pro—Gly—Pro.
С одной стороны, наличие общего гептапептидного ядра в структуре гипофизарных гормонов указывает на эволюционную взаимосвязь гормонов этой группы. С другой стороны, структурная организация этих гормонов и последовательное изменение функций по мере гидролитического отщепления определенного числа аминокислотных остатков позволяют увидеть, как экономно построены эти пептидные регуляторы. В том же кортикотропине часть аминокислотной цепи (остатки 7—38) способна ингибировать синтез кортикостероидов — один из главных процессов, для стимуляции которого предназначена целая молекула кортикотропина. Этот пептид также был выделен из гипофиза и назван кортикотропин-ингибирующим пептидом:
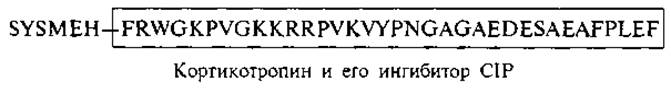
Аналогичная зависимость наблюдается в структуре ß-эндорфина. Часть пептидной цепи (остатки 6—31) была синтезирована и проявила ингибирующее действие на анальгезию, вызываемую ß-эндорфином (Choh Нао Li, 1984). Соответственно этот пептид был назван ß-эндорфин-ингибирующим пептидом, ниже на схеме показано его строение:
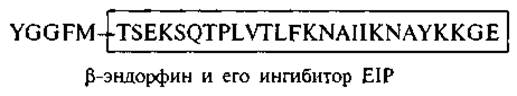
Однако не всегда фрагменты НП, оставшиеся после гидролиза целой молекулы, ингибируют действие исходного пептида. Фрагмент галанина 1—15 оказывает потенцирующее влияние на активность исходного пептида, за счет того что повышает чувствительность селективных к нему рецепторов в гиппокампе.
Общность принципов построения пептидных регуляторов наблюдается не только при буквальной гомологичности структур, но и при сходстве “структурных мотивов”. Это особенно важно при анализе регулирующих функций пептидов различных групп, например нейропептидов и гормонов пищеварительного тракта. Ниже представлено сравнение структур меланостатина (MS) — нейропептида, содержащегося в мозге, надпочечниках и сердце, кишечного пептида, ингибирующего экзокринную секрецию поджелудочной железы (YY) и панкреатического пептида (РР), регулирующего пищеварение и стимулирующего функции поджелудочной железы (Oxford Dictionary..., 1967):
MS: YPSKPDN PGEDAPAEDMARYYSALRHYIN LITRQRY-N H2
YY: YPIKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY—NH2
PP: APLFPVYPGDNATPEQMAQYAADLRRYINMLTRPPY-NH2
Очевидно, что представленные структуры гомологичны друг другу, но проявляют при этом различные активности. Не только удаление части полипептидной цепи, но и замена одного аминокислотного остатка другим в пределах определенной аминокислотной последовательности может привести к изменению смысла сигнала на противоположный: в частности, ингибирующий сигнал YY становится стимулирующим при замене нескольких аминокислот. В то же время некоторое удлинение пептида на С-конце позволяет существенно пролонгировать его действие при сохранении специфической активности, что было показано на примере АКТГ4 (0 и тафцина (Пономарева-Степная и др., 1984; Потаман и др., 1992). Создается впечатление, что N-конец НП более семантически значим, чем участки его С-конца.