Фармакогнозія з основами біохімії рослин - Ковальов В. М. 2004
Загальна частина
Стандартизація лікарської рослинної сировини
Лікарська рослинна сировина — це продукція міжгалузевого призначення і широкого застосування. Відповідно до Декрету Кабінету Міністрів України «Про стандартизацію і сертифікацію», вона підлягає обов’язковій стандартизації і сертифікації. В Україні створена і набуває розвитку національна система гарантування якості лікарських засобів, до яких належить і лікарська рослинна сировина.
Правові відносини, що пов’язані із створенням, реєстрацією, виробництвом, контролем якості і реалізацією лікарських засобів, у тому числі лікарської рослинної сировини і продуктів її переробки, регулює Закон України «Про лікарські засоби», введений в дію Постановою Верховної Ради України від 4 квітня 1996 р.
Відповідно до Закону керівництво у сфері створення, виробництва, контролю якості, реалізації лікарських засобів здійснює Міністерство охорони здоров’я України (МОЗ України). У 1998 р. були прийняті деякі передбачені Законом документи, а саме: «Порядок державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за державну реєстрацію (перереєстрацію) лікарських засобів» (постанова № 569 від 27.04.98 р.), «Положення про Державну інспекцію з контролю якості лікарських засобів Міністерства охорони здоров’я України» (постанова № 179 від 16.02.98 р.), порядок проведення доклінічних випробувань (наказ № 259 від 16.08.96 р.) тощо. Затверджений порядок створення і введення у виробництво лікарських засобів (наказ № 87 від 04.09.96 р.).
На МОЗ України та його департаменти покладено обов’язок забезпечення державного контролю за дотриманням законодавства щодо виробництва, експорту, імпорту, оптової та роздрібної торгівлі, зокрема ЛРС. та проведення державної політики у цій сфері; проведення сертифікації лікарської рослинної сировини і препаратів на її основі, видачу ліцензій на оптову і роздрібну реалізацію товарів цієї групи; організацію і розробку проектів державних програм з контролю за ринком лікарських засобів, у тому числі лікарської сировини, препаратів рослинного походження, біологічно активних харчових добавок, косметичних засобів тощо.
Спеціальним органом державного контролю за якістю лікарських засобів є державна інспекція, їй підпорядковані державні інспекції з контролю за якістю лікарських засобів в Автономній Республіці Крим, областях, містах Києві і Севастополі. Вони проводять регулярні перевірки лікарських препаратів і лікарської рослинної сировини, що реалізуються в Україні, а також попередній контроль на відповідність вимогам стандарту перших п’яти дослідних промислових серій лікарської рослинної сировини або фітопрепаратів, виробництво і переробку яких опановує підприємство-виробник.
Уповноваженими державними органами МОЗ України, які вирішують питання, пов’язані з реєстрацією нової лікарської рослинної сировини і фітопрепаратів, є;
Державний науково-експертний центр лікарських засобів МОЗ України — організація, яка проводить експертизу матеріалів доклінічного й клінічного дослідження препаратів з лікарської рослинної сировини;
Фармакопейний комітет — науково-експертний орган, який проводить експертизу і затверджує нормативну аналітичну документацію (тимчасові фармакопейні статті та фармакопейні статті) на лікарську рослинну сировину, готові лікарські засоби, лікарські і допоміжні субстанції. Затвердження і перегляд АНД Фармакопейний комітет здійснює тільки за умов відповідності її нормативній технологічній документації (технологічним регламентам виробництва).
Фармакопейний комітет робить висновок про державну реєстрацію лікарської рослинної сировини і препаратів рослинного походження; бере участь в атестації виробництва лікарських форм і лабораторій з контролю їх якості; розробляє Державну фармакопею України і галузеві нормативні документи, що регламентують вимоги до якості лікарських засобів.
МОЗ України поступово приводить вимоги законодавства щодо контролю за якістю і безпекою лікарських засобів у відповідність до законодавства Європейського Союзу. Тепер Україна має статус спостерігача в Європейській фармакопеї і згодом зможе претендувати на отримання статусу її повноправного члена.
Таким чином, в Україні створені і розвиваються три ланки системи забезпечення і гарантування якості лікарської рослинної сировини:
система реєстрації та ліцензування, встановлена на національному рівні законами та підзаконними актами;
система контролю якості — лікарська рослинна сировина перед реалізацією обов'язково проходить випробування на відповідність вимогам ТФС і (або) ФС у відділах технічного контролю (ВТК) підприємств: крім того, в Україні діють лабораторії з контролю за якістю лікарських засобів, які проводять незалежний аналіз готової продукції;
введення на підприємствах фармацевтичної промисловості України принципів і правил належної виробничої практики (GKIP — Good manufacturing practice).
Україна дотримується правил GMP, які відповідають вимогам ВООЗ і країн ЄЄ. Першим кроком до забезпечення європейського рівня якості всієї продукції підприємств фармацевтичної галузі було затвердження Методичних вказівок МВ 64У-1—97 «Виробництво лікарських засобів. Належні правила та контроль якості». З 01.01.2002 р. правила GMP будуть в Україні обов’язковими. Впровадження принципів GMP викличе підвищення відповідальності виробників за якість своєї продукції, що обумовлено самодисципліною, а не тільки інспектуванням органів державного нагляду.
Постановою Кабінету Міністрів України № 244 від 19.03.97 р. затверджено план заходів щодо поетапного впровадження в Україні вимог директив Європейського Союзу, санітарних, екологічних, ветеринарних, фітосанітарних норм, міжнародних та європейських стандартів. Протягом 1998-2000 рр. реалізуються галузеві програми впровадження в Україні стандартів для конкурентоспроможної продукції, гармонізованих з міжнародними і європейськими стандартами. Відповідальними виконавцями цих програм в галузі фармацевтичної промисловості є МОЗ України і Державний комітет стандартизації, метрології та сертифікації України.
Аналітична нормативна документація
Нормативний документ на лікарську рослинну сировину, згідно з ДСт У 1.0 — 93 «Державна система стандартизації України» — це документ, що встановлює правила, загальні принципи або характеристики, які стосуються різних видів діяльності або їх результатів. Стандарт — це нормативний документ, в якому встановлені для загального і багаторазового використання правила, вимоги, загальні принципи або характеристики для досягнення оптимального ступеня упорядкування в певній області.
Аналітичними нормативними документами, які регламентують якість ЛРС фармацевтичних підприємств, є тимчасова фармакопейна стаття або фармакопейна стаття. На підприємствах іншого профілю (харчової, парфумерно-косметичної промисловості тощо), які використовують лікарську рослинну сировину, нормативними документами будуть державні стандарти України або технічні умови України.
Фармакопейна стаття України (ФС У) — аналітичний нормативний документ, який встановлює вимоги до лікарських засобів, у тому числі до лікарської рослинної сировини, її упаковки, умов і термінів зберігання, методів контролю якості.
Тимчасова фармакопейна стаття України (ТФС У) — це фармакопейна стаття, строк дії якої обмежений 1-3 роками. Затверджується на перші промислові серії нових видів ЛРС і фітопрепаратів, що рекомендовані до медичного застосування або використання в фармацевтичній промисловості.
Державні стандарти України (ДСт У) реєструються Держстандартом на багатотонажну продукцію і рослинну сировину, що використовується в багатьох галузях народного господарства.
Технічні умови України (ТУ У) — нормативний документ, який встановлює вимоги до конкретної продукції (у даному випадку ЛРС) і регулює відносини між постачальником (виробником) і споживачем продукції.
Галузеві стандарти України (ГСт У) — це стандарти, в яких викладені додаткові технічні умови для виготовлення і постачання у даному випадку лікарського засобу або лікарської рослинної сировини (науково-технічні терміни, позначення, загальнотехнічна документація, технологічні норми тощо), наприклад ГСт У 64-195. «Сировина лікарська рослинна. Порядок встановлення терміну придатності».
У залежності від того, яка організація з стандартизації (міжнародна, регіональна чи національна) приймає стандарти, вони відповідно поділяються на міжнародні, регіональні, національні. Крім того, існують міждержавні стандарти (ГОСТ), які прийняті державами, що приєдналися до Положення щодо проведення узгодженої політики в галузі стандартизації, метрології та сертифікації. ГОСТи використовуються цими державами безпосередньо.
Державний стандарт України для іншої сторони (будь-якої держави світу) є національним стандартом.
Після проголошення незалежності України виникла необхідність розбудови національної системи стандартизації лікарських засобів. Важливішим завданням Фармакопейного комітету (ФК) МОЗ України, який діє на базі ДНЦЛЗ з 19 березня 1992 р., є розробка Національної фармакопеї (НФ). У складі ФК створено відділ «Державна фармакопея України», який здійснює гармонізацію вимог НФ України з Європейською, Американською фармакопеями, а також з фармакопеями країн СНД, перш за все Росії.
НФ України, яка створюється, буде містити два види статей: загальні та окремі. До загальних належать статті, які:
регламентують загальні положення та визначають термінологію, скорочення тощо;
присвячені загальним питанням фармакопейного аналізу, таким як: «Хімічні стандартні зразки», «Валідація аналітичної методики», «Статистика» тощо;
описують і встановлюють загальні вимоги до лікарських форм і субстанцій, наприклад «Настої та відвари», «Збори», «Корені», «Листки» тощо;
описують і регламентують деякі методологічні і метрологічні вимоги до методів контролю якості лікарських засобів («Хроматографія», «Спектрофотометрія», «Токсичність», «Однорідність дозування» тощо). Загальні статті мають жорсткий нормативний характер, тому їх слід сприймати як керівництво до дії при розробці та оцінці будь-яких методів контролю якості лікарської сировини.
До окремих статей належать статті, що описують вимоги до конкретних видів лікарської рослинної сировини і лікарських препаратів. Зважаючи на більшу невизначеність хімічного складу ЛРС, окремі статті носять інформаційно-нормативний характер.
Усі категорії АНД на лікарську рослинну сировину (ФС, ТФС, ДСт У, ТУ У) уніфіковані, тобто мають однакову будову, зміст і викладення матеріалу згідно із ГОСТом 42У-1-92. «Порядок розробки, узгодження та затвердження нормативно-технічної документації на лікарські засоби та лікарську рослинну сировину».
Окремі ФС і ТФС на збори і лікарську рослинну сировину містять такі розділи:
склад (для збору), латинську, українську та російську назви лікарської рослини (рослин) і родини;
зовнішні ознаки; мікроскопія; якісні реакції;
розпадання (для продукції у брикетах та різано-пресованої);
відхилення від маси (для продукції в брикетах та різано-пресованої);
числові показники: вміст фармакологічно активних компонентів або біологічну активність;
вологість; золу загальну; золу, нерозчинну у 10 % розчині хлористоводневої кислоти;
подрібненість; частини сировини, що змінили колір;
інші частини рослини, що не підлягають заготівлі; органічні домішки; мінеральні домішки;
упаковка; маркірування; транспортування; зберігання: термін придатності; основна фармакологічна дія.
Вміст БАР вказує нижні припустимі межі (у процентах), а для всіх інших показників норматив обмежує верхні межі норми.
Номер документа складається з категорії АНД, коду МОЗ України, порядкового номера статті, коду організації, що розробила документ, і року затвердження. Наприклад,
ФС |
42У- |
001- |
002- |
2000 |
Категорія АНД |
Код МОЗ України |
Порядковий номер статті |
Код виробника |
Рік |
Фармакопейний комітет веде послідовну нумерацію затверджених ФС або ТФС. ФС і ТФС після затвердження реєструються в Державному реєстрі лікарських засобів України і отримують номер.
Порядок розробки, узгодження і затвердження АНД на лікарську рослинну сировину
Для впровадження у виробництво нових видів лікарської рослинної сировини або препаратів слід здійснити ряд послідовних заходів щодо створення аналітичної нормативної документації, матеріально-технічної бази виробництва, контролю за виробництвом та якістю.
Механізм взаємодії розробника та виробника у процесі створення та впровадження лікарського засобу подано на схемі.
Взаємодія розробника і виробника в процесі створення і впровадження лікарських засобів
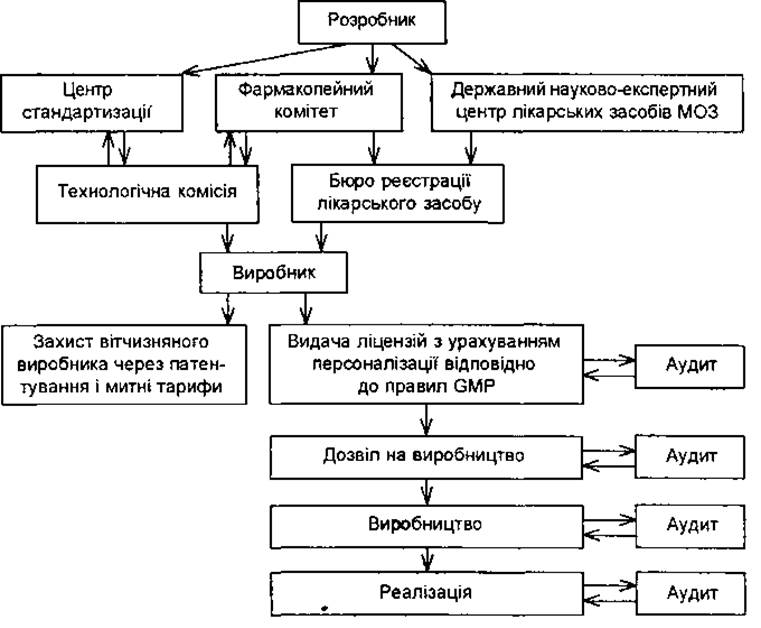
Розробник нової продукції дає виробнику матеріали, які обгрунтовують перспективи впровадження лікарського засобу (результати наукового вивчення специфічної дії, проект тимчасової фармакопейної статті). Виробник приймає рішення щодо доцільності створення та впровадження у виробництво лікарського засобу під своєю торговою маркою. Згідно з проектом ТСФ. він виготовляє та контролює дослідні партії лікарського засобу, надає їх для експериментальних та клінічних досліджень на сертифіковані бази Державного науково-експертного центру лікарських засобів МОЗ України. Дослідження проводить на договірній основі між виробником та базами.
За затвердженим дослідно-промисловим, пусковим або промисловим регламентом виробник виготовляє та випробовує дослідні партії лікарського засобу (не менш як п’ять серій) з метою перевірки їх якості, розробленої технології, обгрунтування показників та норм, які вводяться в проект аналітичної документації. Державний науково-експертний центр лікарських засобів МОЗ України проводить експертизу поданих матеріалів та дозволяє клінічні випробування. На підставі отриманих результатів він затверджує інструкцію з застосування лікарського засобу і рекомендує препарат до впровадження. Фармакопейний комітет затверджує ТФС та повідомляє про це Державну інспекцію з контролю якості лікарських засобів.
Після затвердження АНД виробник виготовляє п’ять промислових серій лікарського засобу, які направляє на попередній контроль до Державної інспекції з контролю якості лікарських засобів МОЗ України. За результатами проведених випробувань Держінспекція робить висновок про відповідність якості лікарського засобу вимогам аналітичної документації.
Дозвіл на промисловий випуск і застосування лікарського засобу в медичній практиці видає МОЗ України. Реєстрацію нового лікарського засобу здійснює Бюро з реєстрації МОЗ України на три роки і вносить його у відповідний розділ Державного реєстру лікарських засобів України (Держреєстр).
Реалізація ЛРС і препаратів з неї здійснюється тільки за наявності сертифікату якості (протоколу аналізу), який видається виробникам і гарантує споживачеві доброякісність продукції.