Фармакогнозія з основами біохімії рослин - Ковальов В. М. 2004
Спеціальна частина
Пептиди та білки
Лектини
Лектини (від латин. legere — вибирати) — це протеїни або глікопротеїни, які здатні зв’язувати сахар і забезпечувати таким чином можливість аглютинувати клітини і преципітувати глікокон’югати.
Лектини містять як мінімум дві ділянки, які реагують з вільними моно- і олігосахаридами, а також із залишками сахарів у складі полісахаридів, глікопротеїнів, гліколіпідів. У найпростішій формі взаємодія лектинів з вуглеводами проявляється у вигляді реакції аглютинації часток і клітин, наприклад еритроцитів або преципітації полісахаридів і глікопротеїнів.
Відкриттю лектинів сприяла проблема токсичності рицинової олії (Oleum Ricini), що не давала спокою багатьом фармакологам і токсикологам кінця XIX ст. Початок вивчення лектинів був покладений роботами П. Г. Штильмарка, який встановив, що отруйна речовина насіння рицини — лектин рицин викликає аглютинацію та гемоліз еритроцитів. Саме цю подію в історії науки вважають днем зародження нової галузі — лектинології.
Сучасний етап розвитку вчення про лектини почався після 1945 р., коли У. Бойд виявив аглютиніни, специфічні до груп крові. У нашій країні значний внесок у дослідження лектинів внесли українські вчені М. Д. Луцик та Є. М. Панасюк. Тепер центр дослідження лектинів знаходиться в Інституті молекулярної біології та генетики НАН України. Дослідження лектинів пов’язані з отриманням чистих препаратів і встановленням їх вуглеводної специфічності. До 1965 р. було відомо лише три кристалічні лектини (фітогемаглютинін, конканавалін А і рицин). Тепер кількість їх перевищує 100.
Будова і класифікація лектинів
Небілковими компонентами лектинів є вуглеводи та іони двовалентних металів Ca2+, Mn2+, Zn2+, Mg2+, Co2+, Ni2+, Cd2+ та ін.
Для більшості лектинів іони металів обумовлюють специфічність взаємодії з вуглеводами. Видалення металів з молекули призводить до зниження або навіть втрати їх біологічної активності. Разом з тим для деяких лектинів метали не є обов’язковими компонентами, наприклад аглютиніни зародків пшениці, лектини тварин.
Кількість вуглеводів у різних лектинах коливається в широких межах — від 3 до 80 %, але в типових випадках становить 3-10 %. Серед моносахаридів, які утворюють основний ланцюг, як правило присутні N-ацетилглюкозамін і маноза. Вуглеводний компонент не завжди має значення для біологічної активності лектинів. З відомих лектинів конканавалін А і лектин гороху взагалі не містять сахарів.
Амінокислотний склад лектинів еволюційно віддалених організмів істотно розрізняється, тому говорити про єдиний характерний тип будови первинної структури неправомірно.
Молекули відомих лектинів, за винятком незначної кількості, побудовані з декількох поліпептидних ланцюгів, або субодиниць, тобто мають четвертинну структуру. Субодиниці можуть бути однаковими або різними. Серед рослинних лектинів спостерігаються ди- та тетрамірні форми. Лектини тварин частіш за все є полімерами вищого порядку. Поліпептидні ланцюги в молекулах лектинів можуть з’єднуватись як нековалентними зв’язками (гідрофобні, водневі і сольові), так і дисульфідними. Різноманітні варіанти комбінації поліпептидних ланцюгів у молекулах зумовлюють існування ізоформ лектинів. Специфічність ізоформ до вуглеводів може бути різною.
Одна з перших класифікацій лектинів, яка збереглася до теперішнього часу, була запропонована О. Мьокела.
Згідно з нею специфічність взаємодії лектинів з вуглеводами визначається положенням гідроксилу при С3 і С4 та D- чи L-формами сахару. Виходячи з цього всі лектини розділяють на чотири групи, специфічні до таких сахарів:
1) 3,4-ОН цис, L-форма (L-фукоза, L-галактоза);
2) 3,4-ОН цис, D-форма (D-галактоза);
3) 3,4-ОН транс, D-форма (D-глюкоза, D-маноза);
4) 3,4-ОН транс, L-форма (L-глюкоза, L-гулоза).
Типи вуглеводів у залежності від положення гідроксилу і форми піранозного циклу:
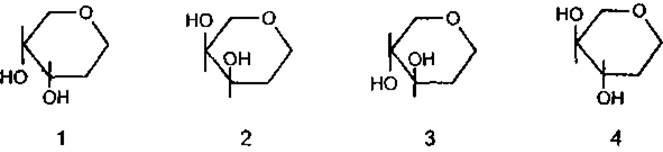
Лектини, які взаємодіють з вуглеводами четвертої групи, невідомі. Інша класифікація включає 9 груп лектинів за їх специфічним ставленням до таких моносахаридів як L-фукоза, D-галактоза, D-глюкоза, D-маноза, М-ацетил-D-глюкозамін, N-ацетил-D-галактозамін, М-ацетил-D-галактозамін разом з галактозою, N-ацетил-D-глюкозамін разом з D-глюкозою, N-ацетилнейрамінові кислоти.
Наведені класифікації умовні, оскільки не враховують тонку специфічність лектинів до олігосахаридів. Іноземні фірми дають комерційну класифікацію лектинів, яка включає відомості про окремі олігосахариди.
Більш обгрунтованою є класифікація комбінованого характеру, яка поділяє лектини на три групи.
За вуглеводною специфічністю: лектини, які реагують з кислими сахарами; лектини, які реагують з нейтральними сахарами.
За структурно-хімічною рекогніцією (впізнаванням) вуглеводів:
лектини, які реактивні тільки до кінцевих залишків; лектини, які реактивні до кінцевих ди-, три- і тетрасахаридів; лектини, які реактивні до олігосахаридів внутрішніх частин ланцюгів.
За функціональною активністю:
прості лектини, які аглютинують або не аглютинують; мітогенні лектини; токсичні лектини.
Досі немає єдиної уніфікованої класифікації лектинів, тому використовують усі відомі залежно від мети дослідження.
Поширення та біологічна роль лектинів
Лектини характерні для організмів будь-якого рівня організації — від вірусів та бактерій до ссавців. Перші очищені лектини мікроорганізмів були одержані в кінці 70-х рр.— токсини бактерій Pseudomonas aeruginosa і грибів Streptomyces spp. Докладно вивчено структуру аглютиніну вірусу грипу. Пектини виявлені у лишайниках. Відомості про лектини папоротей і соснових відсутні. Найбільша кількість лектинів знайдена в квіткових рослинах, серед яких досліджено декілька тисяч видів. Лектини виявлені в багатьох представників безхребетних і хребетних тварин. Лектиноподібні білки знайдені на поверхні тромбоцитів, у тканинах печінки, легенів, серця, плаценти, селезінки людини.
Наявність лектинів у живих об’єктах різних еволюційних рівнів свідчить про їх важливе біологічне значення, але універсальна функція цих білків до кінця ще не розкрита. Найаргументованішими є положення про роль лектинів:
як факторів «впізнавання» молекул і клітин у процесах міжклітинних взаємодій;
у видаленні ушкоджених глікопротеїнів і клітин з кровообігу у ссавців;
в агрегації клітин у нижчих рослин і тварин.
Безперечно, цікава гіпотеза про участь лектинів у транспортуванні, накопиченні та імобілізації вуглеводів.
У рослин захисна функція лектинів проявляється в запобіганні поїданню їх тваринами, а також у пригніченні росту інфекційних бактерій і грибів.
Дослідження показують, що, можливо, лектини забезпечують специфічність взаємодії пилку і маточки при заплідненні рослин.
Припускають, що лектини насіння рослин завдяки своїй мітогенній дії стимулюють ріст і розвиток зародків.
Методи виділення і дослідження лектинів
Екстракцію лектинів з сировини звичайно проводять 0,9 % розчином натрію хлориду. Якщо сировина містить значну кількість ліпідів, її попередньо знежирюють петролейним ефіром. Екстракт просвітлюють ультрацентрифугуванням. Концентрують лектини осадженням їх з екстракту солями (амонію сульфат) або органічними розчинниками (ацетон, етанол). Отриманий концентрат лектину далі очищають шляхом афінної техніки або іншими методами. Іонообмінну хроматографію, гельфільтрацію і електрофорез використовують для остаточного очищення лектинів, а також для розподілу суміші ізоформ.
Найраціональнішим способом отримання чистих лектинів є афінна хроматографія. Суть методу полягає у зворотній взаємодії лектинів із залишками вуглеводів, які входять до складу сорбентів. Використовують сорбенти природні — сефадекс (на основі декстринів), сефарозу (на основі агарози), хітин, а також штучні. Десорбцію лектинів проводять розчином специфічного вуглеводу,
який блокує активність лектину або зниженням pH до 3,0, що веде до дисоціації комплексу лектин — ліганд.
Дослідження лектинів базується на специфічності їх взаємодії з вуглеводами. Для виявлення лектинів використовують реакцію гемаглютинації у різних варіантах і модифікаціях. Результати її реєструються суб’єктивно (візуально) або об’єктивно (спектрофотометрично). Принцип полягає у тому, що до серії послідовних розведень лектину додають суспензію еритроцитів і після інкубації відзначають аглютинацію. Титр лектину виражають найбільшим розведенням розчину, який дає аглютинацію. Для підвищення чутливості реакції еритроцити можуть бути оброблені протеолітичними ферментами.
Крім реакції аглютинації, для виявлення лектинів використовують реакцію преципітації з глюкопротеїдами і полісахаридами, але вона більш вибіркова і придатна для визначення вуглеводної специфічності лектинів. Взагалі вуглеводна спорідненість лектинів виявляється методом пригнічення активності лектину відповідним сахаром. Як тест-систему використовують реакцію преципітації або гемаглютинації. Негативний ефект цих реакцій свідчить про взаємодію лектину з певним вуглеводом. Кількісну характеристику вуглеводної специфічності дає мінімальна концентрація вуглеводу, яка пригнічує активність лектину.
Використання та біологічна активність лектинів
Специфічність взаємодії лектинів з вуглеводами лежить в основі їх практичного використання як реагентів:
у дослідженні структури та функції клітинних мембран як у нормальних, так і в патологічних умовах (наприклад, злоякісно трансформовані клітини);
при дослідженні впливу взаємодії лектину з мембраною клітини на клітинний метаболізм, включаючи мітогенну та антимітогенну дію лектинів на Т- і В-лімфоцити;
для швидкого визначення груп крові;
для очищення глікопротеїнів у рамках афінної хроматографії на іммобілізованих лектинах;
для ідентифікації бактерій і вірусів.
Крім того, лектини знайшли застосування в судово-медичній експертизі для ідентифікації об’єктів і речових доказів.
Встановлено протипухлинну активність деяких токсичних лектинів, здатних блокувати синтез білка, в першу чергу в пухлинних клітинах, які чутливіші до їхньої дії, ніж нормальні. До таких лектинів належать рицин, абрин, токсин дифтерії, лектин блідої поганки, омели та ін.
Деякі лектини, наприклад конканавалін А, виявляють імуносупресивну дію, яка знайшла використання при трансплантації органів. Як хіміотерапевтичний препарат запропоновано лектин з гемолімфи жука Allomyria dichotoma. Він справляє мітогенну дію на Т-лімфоцити, стимулює продукування інтерлейкіну-2, активізує природні кілери.
Використання пектинів для діагностики на живих об’єктах, а також як лікарські засоби обмежується їхньою високою токсичністю, кумуляцією в організмі, невеликою терапевтичною широтою, а також складністю визначення концентрації цих речовин у крові.