Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Электронные спектры поглощения и кислотно-основные свойства аминокислот в растворах - Буферные системы крови
Уникальным свойством кровеносной системы является очень стабильная величина рН (7.37-7.44). Средняя величина - 7.40. Венозная кровь имеет рН=7.38, артериальная 7.42. Поддержание постоянной величины рН крови обеспечивают, в основном, четыре сопряженных кислотно-основных пары:
> H2CO3 - HCO3-, бикарбонатная
> H2PO4- - HPO42-, фосфатная
> гемоглобиновая,
> белковая
Бикарбонатная буферная система является наиболее управляемой буферной системой внеклеточной жидкости и крови. На ее долю приходится около 10% всей буферной емкости крови. Сопряженная кислотно-основная пара:
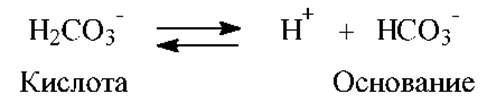
Фосфатная буферная система составляет только 1% буферной емкости крови. Она является одной из основных в тканях. Поддерживается парой: Н2РО4- - донор протонов (кислота), HPO42- - акцептор протонов (основание). Способна поддерживать рН в интервале 6,1 - 7,7.
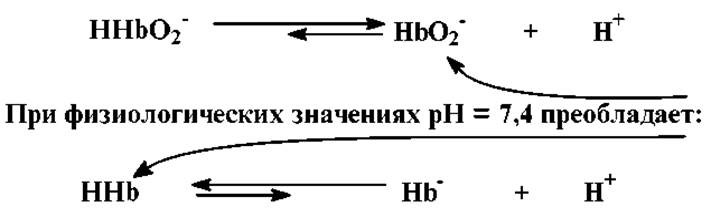
Гемоглобиновая буферная система является основной. На ее долю приходится 75% всей буферной емкости крови. Буферные свойства обусловлены двумя формами гемоглобина: оксигемоглобина HHbO2 c pKa = 6,62 и дезоксигемоглобина HHb с рКа = 8,18. При физиологических значениях рН для HHbO2 преобладает основная форма HbO2-, Для дезоксигемоглобина - кислая HHb:
Механизм действия гемоглобиновой буферной системы состоит в следующем.
> При понижении рН эффективность связывания кислорода гемоглобином существенно понижается (эффект Бора) и оксигемоглобин превращается в дезоксигемоглобин:
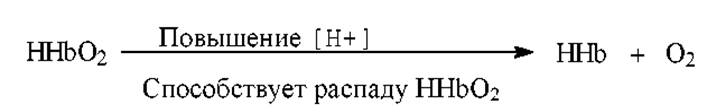
> СО2 в эритроцитах эффективно превращается в Н2СО3 под действием Zn2+ -зависимого фермента карбонатдегидратазы (карбоангидразы). При физиологической величине рН=7.4 Н2СО3, имея рКа = 6.35, диссоциирует практически нацело (на 90% и более), что увеличивает [H+].
> Кислотно-основное равновесие для дезоксигемоглобина смещено в сторону HbO2-, что обеспечивает связывание протонов.
Одновременное протекание всех этих процессов приводит к устойчивому состоянию равновесия и поддерживает постоянную квазистационарную концентрацию ионов Н+.
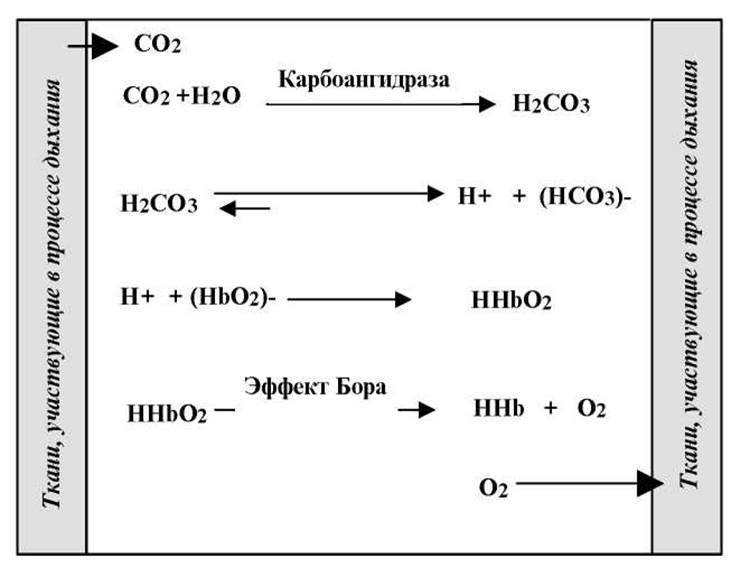
Схематически, все сказанное иллюстрирует рисунок.
Связывание кислорода с гемоглобином изменяет определенным образом структуру белка, что вызывает, в свою очередь, изменение его активности. Этот, чрезвычайно важный, принцип регуляции активности белков весьма распространен в клетках.