Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Хроматография
Аффинная хроматография
В 1968 году Анфинсен, Куатрекасас и др. предложили новый метод выделения белков из биологических сред, основанный на способности белковой молекулы к специфическому связыванию. Это свойство белков является довольно распространенным. Обычно связываемое белком (Р) вещество (S) - есть соединение, с которым белок взаимодействует in vivo, либо синтетический аналог такого соединения, либо антитело, для которого белок выступает антигеном. Сам метод получил название аффинной хроматографии (АХ). Он очень сильно расширил экспериментальную базу биохимических исследований. Методически, АХ очень похож на колоночную хроматографию. Колонка с твердой полимерной стационарной фазой, на которой предварительно закреплено соединение S. При движении смеси белков через колонку на ней задерживается только тот (как правило единственный) белок, который связывается с соединением S. В качестве матрицы для закрепления вещества S применяют: полиакриламид, агарозу, декстран, силикагель.
Так например, один из белков, обнаруженных в лейкоцитах, связывает витамин В12. Полагают, что этот белок секретируется в плазму, где участвует в транспорте витамина В12 к тканям. Долгое время исследование этого белка представляло большие трудности, поскольку его не удавалось выделить в чистом виде с хорошим выходом обычными методами очистки. Методом аффинной хроматографии эта проблема была разрешена, после пришивки витамина В12 к сефарозе, используемой в качестве стационарной фазы. Это почти в 10000 раз увеличило степень очистки специфически связывающегося с витамином В12 белка с выходом >90% в одну стадию.
Подготовка афинного сорбента
Этот вопрос в АХ - первостепенной важности. Афинный сорбент состоит, как правило, из трех частей:
> Носителя;
> пространственной группы;
> лиганда.
Эти три составляющие не являются, однако, абсолютно обязательными. Сам носитель иногда может содержать в своем составе хорошие лиганды, связывающие требуемый компонент анализируемой смеси. Например, остатки глюкозы и маннозы в сефадексе G-75 могут выполнять функции лиганда, связывающего лектин.
Носители
В качестве носителя в АХ находит применение агароза. Наиболее распространенный носитель. К нему после активации бромцианом легко присоединяются различные лиганды и пространственные группы. Недостатки агарозы.
> Биодеградация под действием гидролитических ферментов бактерий.
> Химическая деградация под действием аминов, либо кислот.
> Неспецифическая сорбция. Она связана со способом активации. Бромциан активирует множество гидроксильных групп в носителе, не все из которых доступны для молекул лиганда. Эти свободные ОН-группы могут неспецифически связывать компоненты анализируемой смеси. Кроме того, применяются.
1. Целлюлоза. Часто применяют для получения иммуносорбентов. По гидродинамическим свойствам целлюлоза хуже других сорбентов.
2. Полиакриламид. Преимущества - низкая неспецифическая сорбция белков.
3. Пористое стекло. Обладает высокими механическими свойствами и проницаемостью.
4. Нерастворимые белки. Один из первых носителей этого типа получен обработкой раствора белка этилхлорформиатом. При перемешивании реакционной смеси из раствора выпадает гель в виде мелких частиц
Пространственная группа
Это фактически “мостик” между носителем и лигандом. Он уменьшает стерические затруднения при сшивке носителя с лигандом. Структуры некоторых прстранственных групп приведены на рисунке.
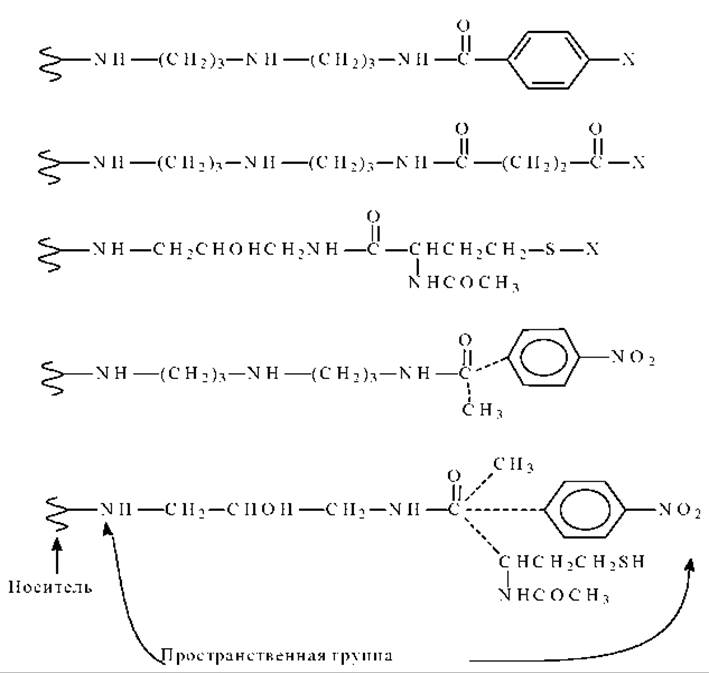
Лиганд
Лиганд может быть связан с носителем непосредственно или через пространственную группу. Иммобилизованный лиганд должен прочно связывать анализируемый выделяемый компонент смеси, чтобы обеспечить удаление примесей из колонки промывкой буфером. В то же время, это связывание должно быть обратимым, чтобы можно было “снять” белок с носителя после вымывания примесей.
Афинные сорбенты
В настоящее время наиболее распространены три типа афинных сорбентов:
> иммобилизованные лектины для выделения растворимых гликопротеинов;
> иммобилизованные антитела для получения очищенных препаратов антигенов;
> иммобилизованные кофакторы ферментов.
Иммобилизованные лектины
АХ с использованием иммообилизованных лектинов основана на их избирательном сродстве к различным концевым углеводам в молекулах гликопротеинов. Иммобилизованные конкавалин А или лектин чечевицы специфически связывают, например, гликопротеины с остатками глюкозы или маннозы. Иммобилизованный лимулин применяют для выделения гликопротеинов с высоким содержанием сиаловых кислот. Иммобилизованный агглютинин арахиса специфичен к гликопротеинам, содержащим N-ацетилгалактозоамин и т.д.
Иммобилизованные антитела
Иммуноадсорбция - принцип породивший афинную хроматографию. Очищенный антиген присоединяют к носителю и сорбируют (связывают) на нем специфические антитела. Десорбируют антитело концентрированным раствором антигена. При отсутствии достаточных количеств последнего, белок - антитело элюируют из колонки буферными растворами с низким рН, либо растворами, содержащими солянокислый гуанидин или мочевину.
Высокая избирательность (специфичность) антител - важнейший фактор при использовании их в качестве лиганда. Получают такие антитела иммунизацией животных препаратами антигена.
Иммобилизованные субстраты, ингибиторы и кофакторы ферментов
Оптимальные лиганды для АХ ферментов - это субстраты. Применять последние, однако, сложно. Они быстро превращаются в продукты соответствующей ферментативной реакции. Необходимо принимать специальные меры по торможению реакции с сохранением склонности к специфическому связыванию фермента. Обычно это достигается понижением температуры от -2, до - 50°С. Десорбируют фермент повышением температуры.
Более широко используемыми лигандами являются ингибиторы и эффекторы, которые не затрагивают при связывании активный центр фермента.
К настоящему моменту проведены достаточно обширные исследования по выявлению универсальных афинных лигандов для ферментов. Наиболее подходящими считаются адениннуклеотидные коферменты, такие например, как NAD+, NADP+ и некоторые другие. Около трети из известных исследованных ферментов проявляют активность в присутствии вышеназванных кофакторов. Хорошо зарекомендовал себя в качестве структурного аналога NAD+- содержащих носителей для синтеза сорбентов с широкой специфичностью голубой декстран. Выделение отдельных ферментов из смеси с применением групповых лигандов удается обеспечить варьированием условий.