Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Методы экспериментального исследования структуры белков
Масс-спектрометрия электронного удара
Методы подготовки пробы для масс-спектрометрии
Белковая молекула или ее фрагмент (пептид) содержит, как правило, разнообразные полярные функциональные группы. Это способствует их растворимости в воде, но делает практически не растворимыми в органических растворителях и существенно понижает летучесть. По этой причине долгое время не удавалось выйти на достаточно надежную методологию масс-спектрометрического исследования пептидов. На разработку этой методологии ушло, в общей сложности, более десяти лет. В ее основу положены наиболее совершенные методы химического превращения водорастворимых пептидов в растворимые в хлороформе летучие производные. Один из наиболее универсальных методов получения летучих производных пептидов для массспектрометрического анализа позволяет модифицировать пептиды непосредственно в смеси, содержащей 5-100 нмоль каждого из компонентов. Схема этой модификации предусматривает превращение пептидов в N-ацетил-N,O,S-перметилпроизводные. Аргининсодержащие соединения перед такой химической модификацией превращают в орнитилпептиды. Для определения аргининсодержащих пептидов в исследуемой пробе часть смеси подвергают предварительному аминокислотному анализу или аналитическому электрофорезу с последующим окрашиванием.
Ацетилирование.
Обработка пробы уксусным ангидридом при комнатной температуре в течении одной минуты приводит к защите только концевой аминогруппы пептида Модификация s-аминогрупп достигается через 3 часа. Для сокращения времени ацетилирования а- и s-аминогрупп реакцию проводят в присутствии оснований.
Перметилирование.
Ацетилпептиды метилируют следующим образом. Сначала готовят основание - метилсульфинильный карбанион. Для этого к 3-4мл. диметилсульфоксида добавляют гидрид натрия и выдерживают реакционную смесь 20 мин при 90°С. О завершении реакции судят по появлению оранжево-коричневой окраски и прекращению выделения водорода. Затем к растворенному в диметилсульфоксиде пептиду добавляют в избытке полученный раствор с метилсульфинильным карбанионом. Через минуту добавляют метилиодид и проводят метилирование в течении 70с. По истечению этого времени реакцию тормозят добавлением воды. Полученные перметилированные ацетилпептиды сразу же экстрагируют из смеси хлороформом.
Гидразинолиз аргининовых остатков.
К 5-100 нмоль пептида добавляют 50 мкл. водного раствора гидразингидрата (1:1) и выдерживают в течении 12 мин при 80°С. После этого реакционную смесь охлаждают, добавляют 50 мкл воды, замораживают жидким азотом или смесью этанола с сухим льдом (СО2) и вакуумируют до полного удаления воды. Затем пробу медленно размораживают до комнатной температуры.
В общем виде схема всего процесса модификации пептида перед направлением его на исследования методом масс-спектрометрии электронного удара
приведена ниже.
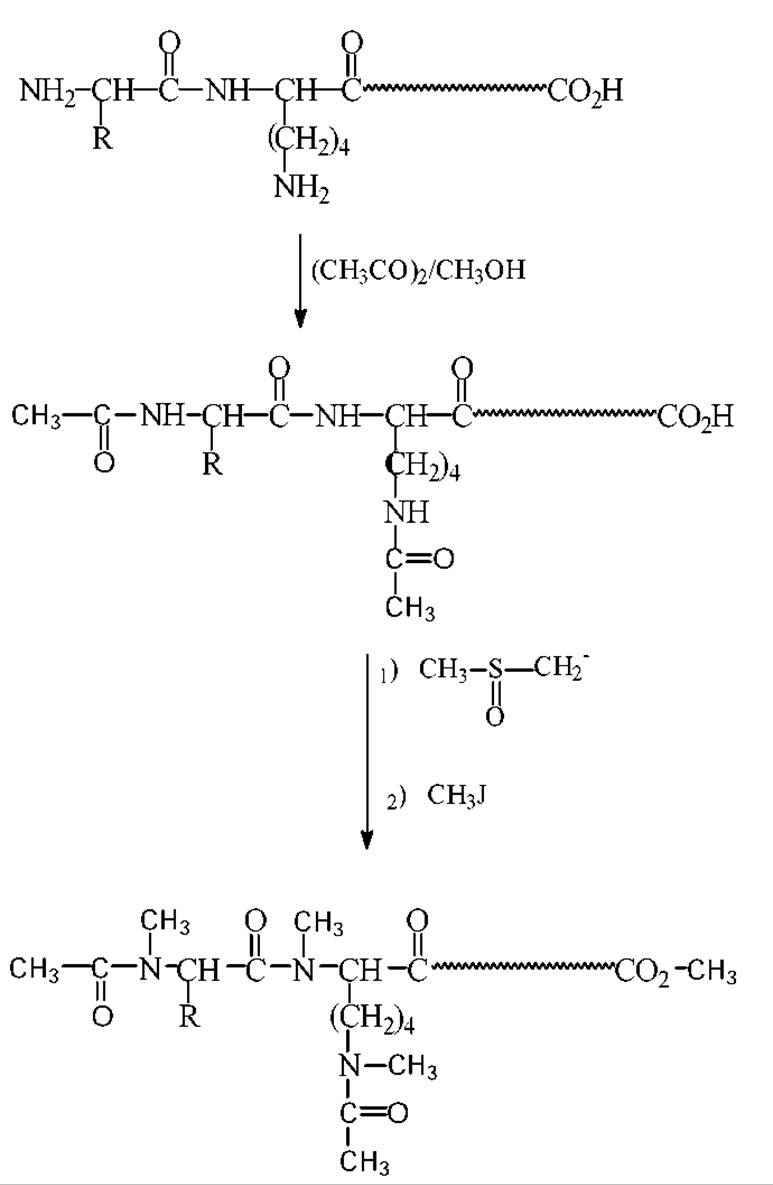
Схема ацетилирования и исчерпывающего метилирования пептидов для проведения масс спектрометрии
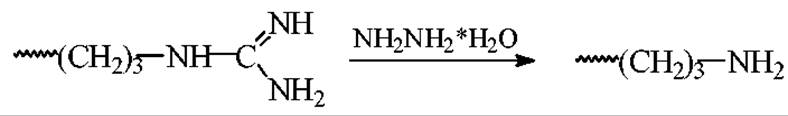
Превращение остатков аргинина в остатки орнитина