Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Аминокислоты
Аминокислоты
Специфические реагенты на аминокислоты
Если по каким-либо причинам невозможно идентифицировать пятно по его положению и окраске с использованием общих тестов, существуют реагенты, специфичные к одной аминокислоте или группе аминокислот.
Тирозин
Реакция Фолина и Дениса с а-Нитрозо-β-нафтол. Хроматограмму погружают в 0,1%-ный раствор а-нитрозо-β-нафтола в ацетоне, высушивают при комнатной температуре. Затем погружают ее в ацетон, к которому добавлено 10% (об.) конц. НNО3; высушивают и постепенно прогревают, начиная с одной стороны так, чтобы можно было следить за появлением пятен на хроматограмме. Желтый цвет бумаги светлеет в участке, который достаточно прогрет. Тирозин определяется по красной окраске, чувствительность ~ 1 мкг. Триптофан дает окраску от серой до коричневой с меньшей чувствительностью. Фенол и коллидин следует удалять промыванием смесью (1:1) ацетон-диэтиловый эфир. Тирозин определяют также с помощью теста Паули (см. ниже).
Реакция Милонна - реакция с закисными и окисными солями ртути и азотистой кислотой. Чувствительность около 50 мкг/мл.
Триптофан и родственные соединения
Реагент Эрлиха
1. Хроматограмму погружают в 1%-ный (масс./об.) раствор парадиметиламинобензальдегида в смеси (9:1) ацетон-конц. НСl; выдерживают при комнатной температуре несколько минут. Триптофан дает пурпурное пятно, пирролы и родственные соединения дают красные пятна.
2. Можно также опрыскать хроматограмму 2%-ным раствором п-диметиламинобензальдегида в 5%-ной НСl и затем высушивать при комнатной температуре. Триптофан дает пурпурную окраску, ароматические амины и цитруллин желтую.
УФ-облучение
1. Бумагу высушивают при комнатной температуре. Наблюдают в УФ-свете. Триптофан или совсем не дает окрашивания или дает очень слабое окрашивание (что обусловлено наличием продуктов распада, и обычно соответствующее им пятно расположено немного впереди истинного). Некоторые родственные соединения хорошо видны в результате взаимодействия с бумагой, например кинуренин (синее окрашивание); кинуреновая кислота (сине-зеленое); гидроксикинуреновая кислота (зеленоватожелтое); аминоацетофенон (небесно-голубое); 2-амино-3-гидроксиацетофенон (желтое); ксантуреновая кислота (синее); антраниловая кислота (сине-фиолетовое); гидроксиантраниловая кислота (небесно-голубое). Ароматические растворители иногда мешают.
2. Хроматограмму опрыскивают смесью (6:1) хлорная кислота (70-72%-ная) - вода. Триптофан в течение 10 мин дает устойчивую и интенсивную зелено-синюю флуоресценцию. Последующее опрыскивание 1%-ным раствором FеСl3 дает красновато-желтую окраску.
Терефталевый альдегид в кислой среде. Опрыскивают 0,2%-ным раствором терефталевого альдегида в ацетоне, содержащем 10% уксусной кислоты. Хроматограмму прогревают при 105°С в течение 3 мин. Триптофан дает синее пятно. Этот реагент чрезвычайно чувствителен.
Гистидин
Реагент Паули. Раствор 1 (1%-ная сульфаниловая кислота в 1 М НСl) и раствор 2 (5%-ный водный раствор NaNO2) выдерживают в холодильнике. Равные объемы этих растворов смешивают (также на холоду) за 5 мин до использования. Осторожно, чтобы не смыть пятна. опрыскивают бумагу. Затем опрыскивают 15%-ным раствором Na2СО3. Гистидин и другие имидазолы сразу дают красную окраску. Окрашенные пятна с меньшей чувствительностью дают также гистамин (розово-коричневое ); тирозин (розовое); ксантин, дииодотирозин (оранжевое); тиамин, триптофан, аденин (розовое); гуанин (оранжево-пурпурное); катехин (пурпурное).
Для уменьшения мешающего влияния тирозина методику можно изменить. Хроматограмму опрыскивают 0,1%-ным раствором п-анизидина в смеси (1:1) этанольных растворов 0,11 М НСl - 10%-ный амилнитрит. Высушивают на воздухе при комнатной температуре. Опрыскивают 1%-ным КОН в этаноле. Перекристаллизованный п-анизидин может “не работать”. Удерживаемые бумагой другие растворители, такие, как фенол и коллидин, должны быть отмыты ацетоном и эфиром.
Терефталевый альдегид. Хроматограмму опрыскивают 0,2%-ным раствором терефталевого альдегида в ацетоне. Прогревают при 105°С в течение 10 мин. Гистидин дает желто-зеленое пятно. Триптофан дает коричневое пятно в УФ-свете. Реагент очень чувствителен, особенно для гистидина.
Фенилаланин
Нингидрин-NаHСO3. Хроматограмму прокрашивают нингидрином (см. выше). При опрыскивании нагретой бумаги разбавленным (0,15 - 10%) раствором NaHCO3 устойчиво только пятно фенилаланина.
Серусодержащие аминокислоты Тетраиодид платины
1. Хроматограмму погружают в раствор: 0,002 М платинохлороводородная кислота-1 М КI - 2 М НСl-ацетон (4:0,25:0,4:76). После высушивания при комнатной температуре окраску усиливают путем обработки парами НСl. Цистин, цистеин, метионин, цистатионин, лантионин, дьенколевая кислота, метионинсульфоксид и другие дают бесцветные пятна на розовом фоне. В случае использования в качестве растворителя фенола или коллидина бумагу следует сначала промыть смесью (1:1) ацетон-эфир.
2. Для большей контрастности хроматограммы (темно-коричневый фон) 0,002 М раствор H2PtCl6 можно заменить на 0,002 М раствор PdCl2, в 0,1 М НСl.
Азид-иод. Хроматограмму опрыскивают 0,025 М раствором I; в 50%-ном этаноле, содержащем 1,5% NaN3. На светло-коричневом фоне моментально проявляются белые пятна цистеина, затем (через 15 мин) цистина, далее (через 60 мин) метионина. Пятна лучше видны в УФ-свете. Этот реагент позволяет обнаруживать также тиамин.
Нитропруссид. Реагент а. Смешивают 1,5 г нитропруссида натрия в 5 мл 1 М H2SO4 + 95 мл МеОН + 10 мл 28%-ного NH3. Фильтруют. Хроматограмму погружают в этот раствор. SH-соединения дают красную окраску. Еще влажную бумагу погружают в раствор б (2%-ный раствор NaCN в 95%-ном МеОН). Расщепление связей —S—S— этим реагентом вызывает появление красной окраски через промежуток времени от нескольких секунд до 10 мин. Для цистина чувствительность 1 мкг. Если нет необходимости определять SH-соединения, используют равные объемы растворов а и б с концентрацией в 2 раза выше. Аргинин при этом дает оранжевое пятно на бледножелтом фоне, переходящее в серо-синее на интенсивно-зеленом фоне.
Глицин
о-Фталевый альдегид. Хроматограмму опрыскивают 0,2%-ным раствором о-фталевого альдегида в ацетоне. Прогревают при 50°С в течение 10 мин. Глицин дает зеленое пятно, в УФ-свете при 365 нм шоколаднокоричневое; гистидин и триптофан - интенсивно желтая флуоресценция при 365 нм. Этот реагент нельзя использовать после хроматографирования в ароматических растворителях.
Аргинин
Реакция Сакагучи. Хроматограмму погружают в 0,1%-ный раствор 8-гидроксихинолина в ацетоне. Высушивают на воздухе. Тщательно опрыскивают раствором 0,2 мл Вг2 в 100 мл 0,5 М NaOH. Аргинин и другие гуанидины дают оранжево-красные пятна.
Орнитин
Ванилин. Хроматограмму опрыскивают 0,2%-ным раствором ванилина в ацетоне, а затем 0,1%-ным раствором КОН в этаноле. Прогревают при 110°С в течение 10 мин. Орнитин дает красное пятно, аналогично реагируют пролин и гидроксипролин.
Иминокнслоты (пролин и гидроксипролин)
Изатин. Хроматограмму опрыскивают 0,2%-ным раствором изатина в н-бутаноле, содержащем 4% уксусной кислоты. Прогревают при 105°С в течение 15 мин. Пролин и гидроксипролин дают устойчивые пятна (синие). Многие аминокислоты дают окраску в этом же диапазоне цветов, которая исчезает при комнатной температуре через несколько часов. Чтобы получить синие пятна только пролина и гидроксипролина, бумагу промывают после проявления в 1 М НСl, а затем в воде.
Чтобы различить пролин и гидроксипролин, хроматограмму погружают сначала в описанный выше раствор, а затем в реагент Эрлиха (см. выше). Все цвета, даваемые изатином исчезают, кроме окраски гидроксипролина, которая переходит из синей в светло-вишневую.
Многократное прокрашивание
За опрыскиванием нингидрином может следовать опрыскивание а-нитрозо-β-нафтолом или реагентом Эрлиха. За ним могут также следовать реагенты, дающие пониженную чувствительность обработки (реагент Паули или Сакагучи). Изатину может предшествовать нингидрин или за изатином может следовать реактив Эрлиха или а-нитрозо-β-нафтол (чувствительность последнего теста при этом снижается). За реактивом Эрлиха может следовать обработка по Сакагучи, даже если предшествующими операциями были опрыскивание нингидрином или изатином. УФ-облучение и обработка иодом не мешают проведению любых последующих тестов.
Реакции по функциональным группам R остатка
В некоторых случаях используют реакции по функциональным группам R-остатков аминокислот. Например по SH-группе цистеина, фенольному гидроксилу в тирозине, гуанидиновой группе аргинина. Исключительно высокую реакционную способность имеет R-группа цистеина, содержащая тиоловую или сульфгидрильную группировку. В щелочных средах цистеин теряет атом серы в результате сложных реакций.
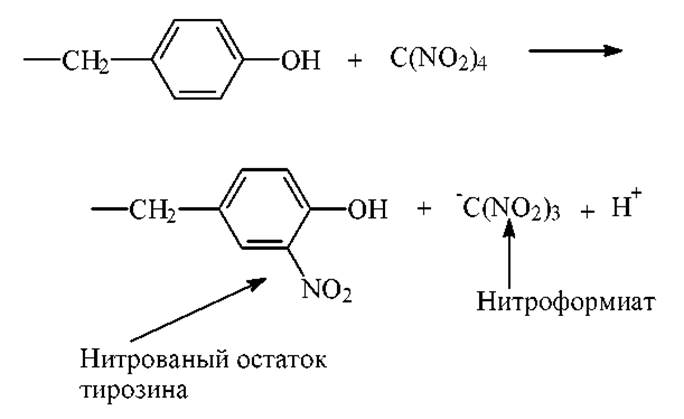
Тетранитрометан в мягких условиях с очень высокой специфичностью реагирует с фенильной группой тирозина:
Цистин, образующийся в результате ковалентного связывания двух остатков цистеина, играет в белковой структуре особую роль. За счет этой аминокислоты образуются поперечные дисульфидные связи.