Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Структура белков
Химическая фрагментация - Секвенирование пептидных цепей на твердофазных носителях
В 1971 г. американский биохимик Ларсен предложил твердофазный (ТФ) анализатор аминокислотной последовательности пептидов. Принцип действия этого анализатора заключается в ковалентном связывании пептида с нерастворимым носителем и последующем последовательном отщеплении аминокислот от пептидной цепи по Эдману. Носитель с нанесенным на него пептидом помещают в колонку, а в качестве элюэнта используются растворы соответствующих реагентов. ТФ-секвенатор технологичнее жидкофазного. Он позволяет анализировать от 500 пмоль до 20 нмоль пептида. ТФ-секвенатор позволяет определять последовательность в 20-30 аминокислотных остатков. Можно анализировать и более крупные пептиды.
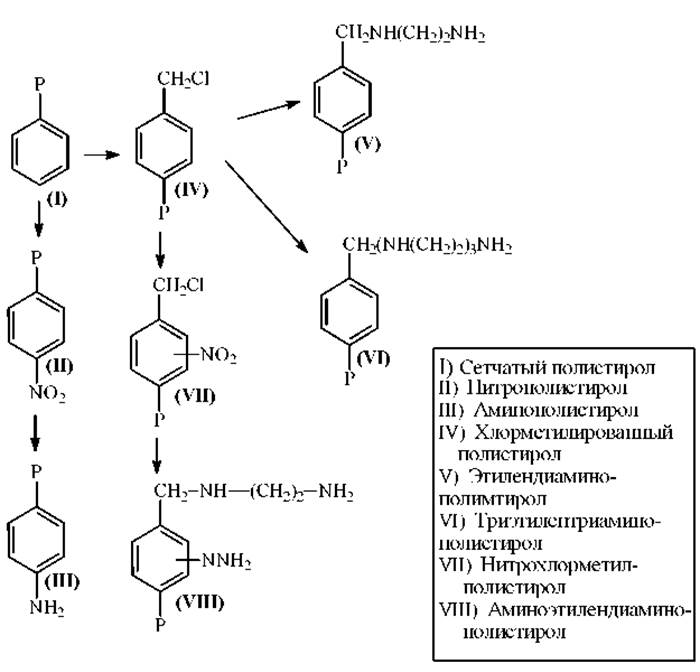
Носители для твердофазных секвенаторов. В качестве носителей для ТФ-секвенаторов используют сополимеры на основе сшитого (сетчатого) полистирола или пористых стекол.
Носители на основе полистирола. Примеры получения некоторых смол-носителей на основе сетчатого полистирола приведены на схеме.
Полимеры для ТФ-секвенаторов должны удовлетворять двум основным требованиям:
1. функциональные группы полимеров должны быть доступны для пептидов и реагентов;
2. смола должна быть механически и химически устойчива в условиях реакции Эдмана.
Носители на основе стекол. В 1973 в качестве носителей для ТФ-секвенаторов были предложены пористые стеклянные шарики следующего состава: 96% кремнезема, 3-4% B2O3, 0.5% Na2O и следовые количества оксидов других металлов. Они производятся в виде необработанных пористых шариков модифицированных разными химическими методами.
Стеклянные шарики очень устойчивы к механическим повреждениям, но заметно ухудшают свои свойства во времени под действием трифторуксусной кислоты (ТФУ). Весьма чувствительны к фтороводороду (плавиковой кислоте).
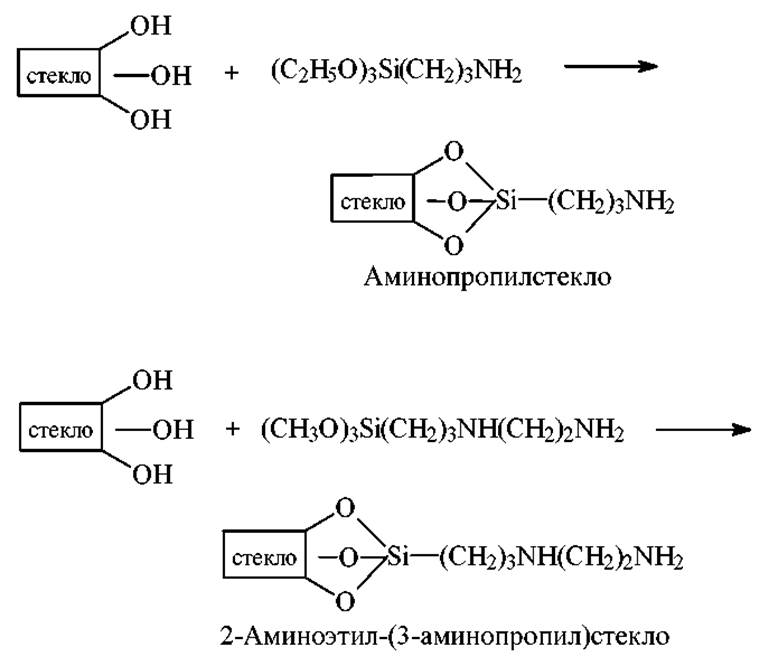
Химическая модификация стекол
Ведение аминогрупп. Для получения аминопропилстекла (АПС) и ß-N-аминоэтил-(3-аминопропил)стекла (ß-АПС) пористые шарики CPG обрабатывают 3-аминопропилтриэтоксисиланом (АПТЭС) и ß-аминоэтил-(3-аминопропил)триметоксисиланом (АЭАПТМС) соответственно.
Получение изотиоцианатного стекла. Для синтеза изотиоцианатаминопропильного носителя аминогруппы аминопропильного стекла активируют п-фенилендиизотиоцианатом (ДИТЦ-стекло).
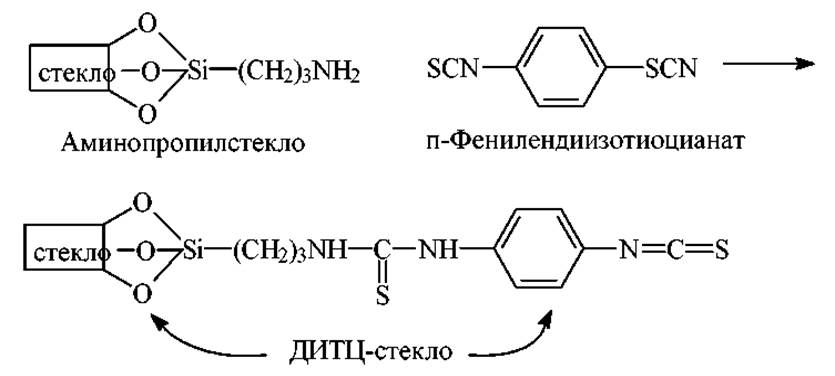
Ограничения. ДИТЦ-стекла можно применять только для анализа пептидов, содержащих остатки лизина или аминоэтилцистеина, по месту расположения которых ПП-цепь присоединяется к носителю (стеклу). Пептиды, которые имеют вышеназванные остатки внутри цепи можно анализировать только до этих остатков, т.е. до точек присоединения. Метод неприменим для аргининсодержащих пептидов.
Связывание пептидов с носителем
Определяющей стадией при ТФ-секвенировании является присоединение пептида к носителю. Эта операция называется иммобилизацией. Используют преимущественно два способа присоединения пептидов к ТФ-носителям.
1. Присоединение по а- и z-аминогруппам пептидной цепи. Пептиды с остатками лизина или аминоэтилцистеина, расположенными как внутри цепи так и на С-конце пептида, эффективно присоединяются свободными аминогруппами к смолам на основе стирола или к аминопропильным стеклам посредством ДИТЦ
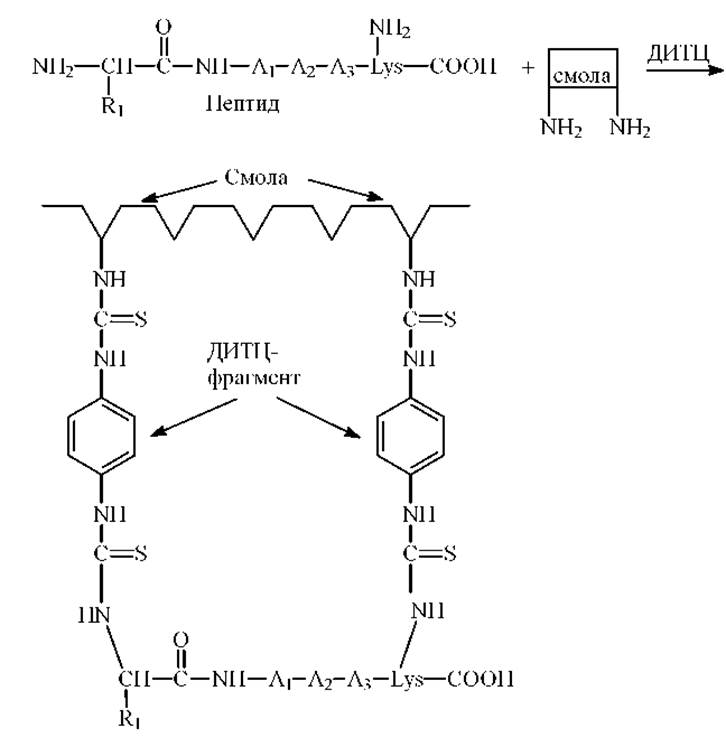
2. Присоединение по карбоксильной группе. Карбоксильную группу С-концевой аминокислоты пептида можно связать ковалентно с аминополистиролом и аминопропилстеклом посредством карбодиимида. Этот метод применим практически ко всем пептидам и может быть использован в микроварианте.
Секвенирование пептидов на твердофазных носителях осуществляют с использованием метода Эдмана или описанных ниже его модификаций.
1. Метод ФИТЦ-ДАБИТЦ. ДАБИТЦ - это аналог ФИТЦ - 4-N-N-диметиламино-азобензол-4’-изотиоцианат:
![]()
ДАБИТЦ образует гидантоин с коэффициентом экстинкции в 2 раза большим, чем с ФИТЦ. Это существенно повышает чувствительность и позволяет анализировать 10-50 пмоль образца.
Недостаток ДАБИТЦ: при обычной температуре он реагирует не количественно. Поэтому применяют двойное карбамоилирование. Вначале с ДАБИТЦ, а затем с ФИТЦ.
2. Метод ДНС - Эдмана. По этому методу перед каждым циклом деградации пептидной цепи отбирают определенную аликвотную часть раствора для анализа N-концевой аминокислоты в виде дансильного производного. Оставшийся раствор пептида анализируют по Эдману. При этом опускается стадия промывки ФТК-пептидов от избытка ФИТЦ и его побочных продуктов, что уменьшает потери веществ в ходе анализа.