Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Пространственная структура белков
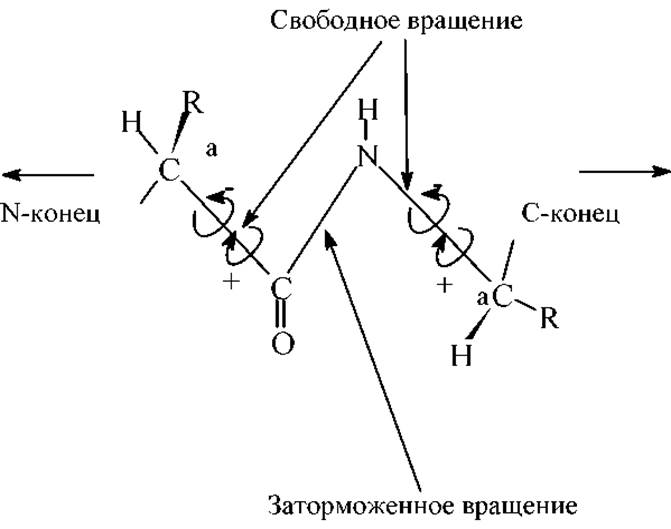
Структурная роль пептидной связи - Геометрические параметры пептидной связи
В клетках живых организмов и растений аминокислоты встраиваются в полипептидную цепь путем сложных биохимических реакций. Эта "полимеризация" представляет собой процесс образования амидных (пептидных) связей. Направление цепи определяют от N-концевой к С-концевой аминокислоте.
Именно в такой последовательности протекает синтез пептидных цепей белков in vivo. Это направление отвечает направлению 5’→3’ информационной РНК.
Почти все наши знания и пространственном расположении атомов в белках основаны на результатах рентгеноструктурного анализа (РСА) простых пептидов, полученных Полингом и Кори в начале 50-х годов. Результаты этих и последующих исследований позволили установить основные геометрические параметры пептидных связей, которые приведены ниже.
Основные структурные особенности пептидной связи.
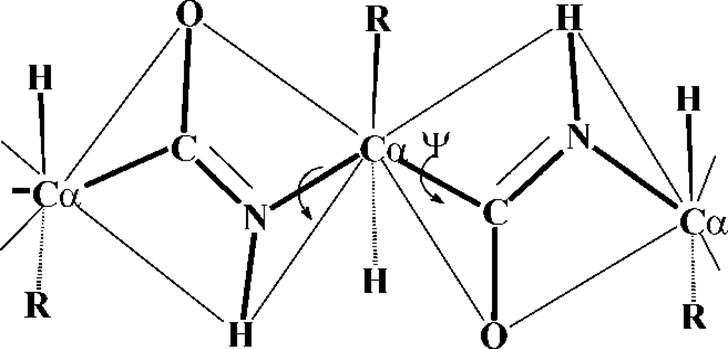
1. Четыре атома пептидной группировки лежат в одной плоскости с а-углеродными атомами. Атомы Н и R-остатков при а-углеродных атомах лежат вне этой плоскости, cм.рис.
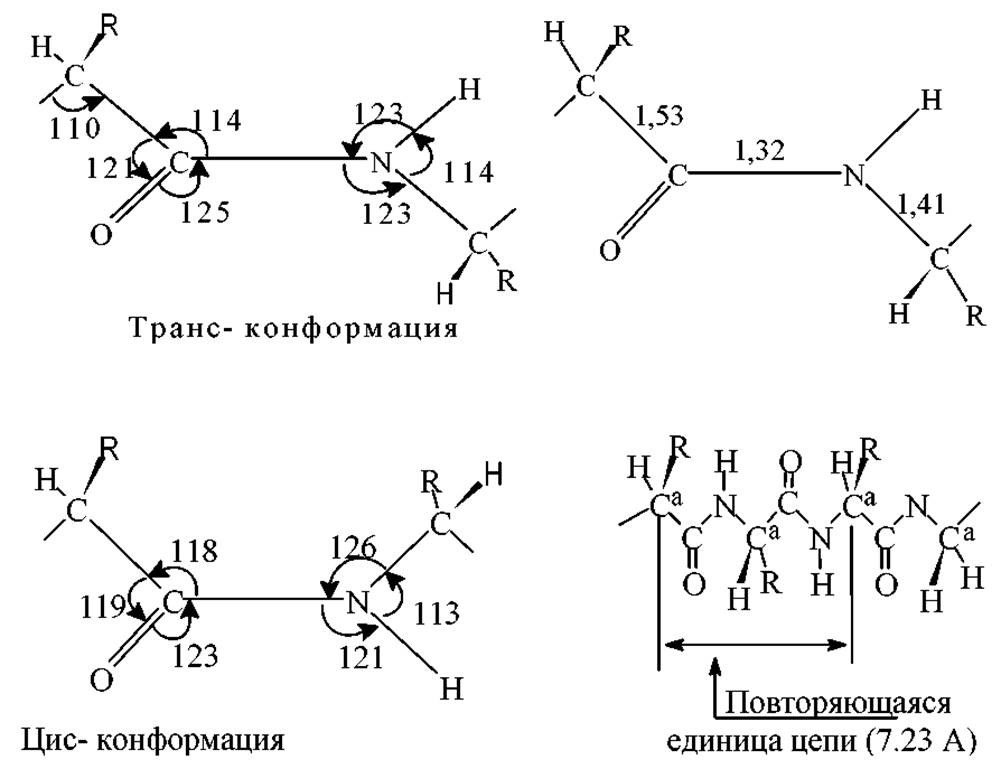
2. Атомы О и Н пептидной связи имеют, как правило, транс-ориентацию. Два а-углеродных атома также имеют транс-ориентацию относительной пептидной связи, посредством которой они связаны. Пептидная связь практически плоская (сумма углов у С- и N-атомов близка к 360∘)
3. При L-конформации всех входящих в пептидную цепь аминокислот, R- группы при каждом из а-углеродных атомов расположены регулярным образом в транс положении относительно друг друга.
4. Длина связи С-N в амидной группе (т.е. в пептидной связи) равная 1.32 Å, имеет промежуточное значение между длиной двойной ковалентной связи (1.21А) и одинарной ковалентной связи (1.47Å). Следовательно, связь С-N имеет частичный характер двойной (п-) связи.
5. Связь С=О на 0.02Å длиннее связи С=О в альдегидах и кетонах. Полинг и Кори объяснили полученные результаты резонансом следующих структур:

Структура (I) совместима со свободным вращением вокруг связи С-N, для структуры (II) такое вращение запрещено. Судя по различиям в длинах связей С’-N и C’-O, результирующую гибридную структуру можно представить как включающую формы (I) и (II) в соотношении 3:2. Иначе говоря, связь С’-N на 40% имеет характер двойной связи. Поскольку структура (II) плоская, а в (I) свободное вращение, то гибридная структура также должна быть плоской.
6. Каждый планарный пептидный фрагмент содержит две связи с а-углеродными атомами, вокруг которых разрешено свободное вращение. Обе они являются a-связями без сколько-нибудь значительного п-вклада. Это связи Са-N и Са-С. Для обозначения соответствующих углов вращения (двухгранных углов) используют обозначения: φ - для С-N и ψ - для Са-С. При полностью расправленной цепи углы φ и ψ считают равными 0∘, и, если смотреть с N-конца, вращению по часовой стрелке на 180∘ приписывают знак "+", а в противоположном направлении - знак "-", см.рис.:
Пептидная группировка в природных белках имеет, как правило, трансконформацию. В напряженных циклических системах (некоторые циклопептиды производные пролина, например), а также при больших заместителях у атома азота в N-алкилированных производных пептидная группировка может находится в цис-форме. Например, одна пептидная группировка в цис-сотоянии есть в субтилизине перед Про-168, две в рибонуклеазе S перед Про-93 и Про-114, одна в карбоксипептидазе А между Сер-197 и Тир-198 и т.д. Из всех аминокислот Про в наибольшей мере способствует образованию цис-коформации.