Химия белка. Структура, свойства, методы исследования - Шендрик А.Н. 2022
Структура белков
Пространственная структура белков
Третичная структура белков
Пептидная цепь, содержащая участки с определенной вторичной структурой, располагается в пространстве обычно так, чтобы элементы вторичной структуры, взаимодействуя между собой и с участками с неупорядоченной структурой, образовывали глобулы (глобулярные белки) или вытянутое волокно (фибриллярные белки). В этих случаях говорят об образовании третичной структуры белковой молекулы. Каждый белок обладает своей уникальной пространственной структурой.
Фибриллярные белки. В фибриллярных белках пептидные цепи имеют преимущественно спиральную структуру или структуру складчатого листа. Интактный белок состоит не из одиночных пептидных цепей, а из их агрегатов. Фиброин шелка, например, состоит из нескольких цепей со структурой складчатого листа, уложенных стопкой так, что каждая цепь со всех четырех сторон окружена цепями в антипараллельной ориентации. В то же время, такой белок как а-кератин (шерсть, волосы, перья, рога, ногти) построен из больших многоцепочечных структур из скрученных спиральных цепей. Эти цепи связаны в пучки или взаимоперекручены так, что образуются надструктуры.
Из фибриллярных белков наиболее изучен коллаген. Это основной компонент соединительной ткани и является главным структурным белком всех живых клеток. Около 30% от массы содержащегося в теле белка приходится на коллаген. В целом, его содержание в биосфере оценивается в 1 млрд.т.
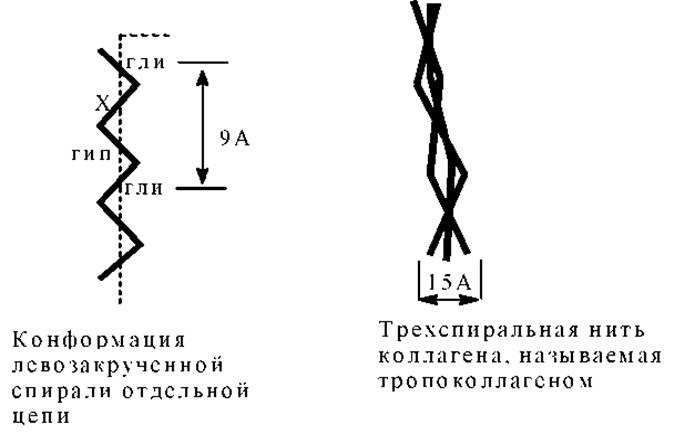
Каждое макроволокно коллагена соединительной ткани представляет собой агрегат молекул коллагена. Длина молекулы коллагена около 3000Å, молекулярная масса = 300 000. Структура молекулы коллагена - специфичная спираль (иногда ее называют тропоколлаген): три одинаковые левозакрученные цепи сплетены в одну и образуют вместе правозакрученную тройную спираль. Каждая тройная цепь имеет гораздо более вытянутую форму, чем исходная молекулярная а-спираль.
Почти треть аминокислотных остатков в ней приходится на глицин, четверть составляют пролин и гидроксипролин, остальное - небольшие количества других аминокислот, включая гидрокислезин. Аминокислотная последовательность довольно регулярно чередуется, причем глицин находится почти в каждом третьем положении. Очень часто встречаются трипептидные фрагменты: Гли-Х-Про; Гли-Х-Гип (гидроксипролин); Гли-Про-Гип. Считается, что последовательность:
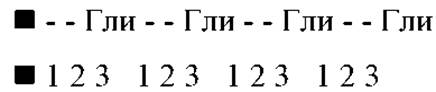
совершенно необходима для образования третичной структуры коллагена.
Тройная спираль коллагена стабилизирована невалентными взаимодействиями (водородными связями) и валентными связями между лизином и гидроксилезином. В результате, третичная структура обладает жесткостью и прочностью. Нить коллагена толщиной в 1 мм. способна выдерживать нагрузки до 100 Н (около 10 Кг силы).
Биосинтез коллагена идет в такой последовательности. Вначале формируются две различные пептидные цепи (а1- и а2-цепи) из аминокислот, в т.ч. пролина и лизина. Далее они агрегируются в спираль состава (а1)2(а2). При образовании тройной спирали некоторые остаткии пролина и лизина в каждой из цепей гидроксилируются. Гидроксилирование осуществляется разными ферментами по пролину и по лизину. Оба фермента используют О2 как источник -ОН группы. Есть свидетельства, что для максимальной эффективности ферментов необходима аскорбиновая кислота. Предполагается, что гидроксипролин стабилизирует цепь за счет водородной связи. Некоторые -ОН группы используются для присоединения углеводов к коллагену. Наследственные нарушения процессов гидроксилирования приводят к серьезным дефектам. Ухудшаются механические свойства тканей (например кожи или связок).
Глобулярные белки. В 1960 г. Кендрю и Перутц с сотрудниками методом рентгеноструктурного анализа впервые исследовали полную трехмерную структуру белковой молекулы. К настоящему времени такие работы выполнены на достаточно большом числе белков. В результате было установлено, что в отличие от фибриллярных белков глобулярные представляют собой плотно упакованные свернутые участки пептидной цепи. Однако нет одной единой формы для всех глобулярных белков. Некоторые среди них - почти правильные сферы, другие - вытянутые элипсоиды, большинство же имеет промежуточную и не всегда правильную форму. В целом же результатом этих исследований явились следующие обобщения.
1. Нативная конформация белка - индивидуальное структурное свойство данного белка, которое определяет и его функциональную индивидуальность, т.е. пространственная структура белка характеристична.
2. Нативная структура белка определяется не до конца ясными “инструкциями” заложенными в его аминокислотной последовательности, т.е. уже в первичной структуре.
3. Всем нативным структурам белков присуще одно общее свойство - это коформация с минимальной энергией, т.е. максимально стабильная.
Существование большого количества складок, поворотов и изгибов в пептидных цепях белков поддерживается различными стабилизирующими силами. Наиболее мощные из них - ковалентные связи, примерами которых могут служить дисульфидные мостики. В некоторых белках они, однако, не обнаружены. Принято, поэтому считать, что стабилизация в целом осуществляется нековалентными взаимодействиями следующих типов:
> электростатические силы притяжения между боковыми цепями с противоположно заряженными ионными группами (ион-ионные взаимодействия), если в состав ПП-цепи входят аминокислоты с полярными R-остатками (лизин, аргинин, аргинин, глутаминовая и аспарагиновая кислоты);
> водородные связи между группами, не участвующими в образовании пептидной связи, например между остатками тирозина и глутаминовой кислоты;
> водородные связи пептидных группировок, которые образуются в спиральных структурах и структурах типа складчатого листа;
> гидрофобные взаимодействия между неполярными боковыми цепями лейцина, валина, изолейцина, аланина, фенилаланина и др. неполярных аминокислот;
> взаимодействия в простетической группе, например между ионом металла и R-группами.
Схематически, все перечисленные виды невалентных межмолекулярных взаимодействий, стабилизирующих пространственную структуру белков представлены на рис. 2.3.
Условно принято, что при расстояниях между взаимодействующими группами в 2-3.1 Å они участвуют в полярных взаимодействиях, а при расстояниях 3.1-4.1Å - в неполярных. Неполярные взаимодействия имеют достаточно сложный механизм и реализуются в основном за счет энтропийного вклада в свободную энергетию процесса структурирования белка взаимодействий с участием молекул воды.
Нативная конформация глобулярного белка очень чувствительна к внешним воздействиям и гораздо менее устойчива, чем у фибриллярного белка.
Для третичной структуры белков выполняются следующие правила.
> Пептидные цепи находятся в наиболее устойчивом состоянии (с наименьшей энергией).
> Все донорные и акцепторные группы, склонные к образованию водородных связей (или любых других донорно-акцепторных комплексов) расположены в благоприятных для образования таких связей местах и, как правило, на поверхности.
> Заряженные остатки располагаются, как правило, на поверхности белка; погружение зарядов внутрь белковой молекулы невыгодно (повышает энергию). Иногда наличие зарядов обнаруживается и внутри молекулы, но они находятся в большинстве случаев на остатках непосредственно участвующих в актах катализа, или выполняющих другие специфические функции.
> Гидрофобные неполярные остатки в глобулярных белках располагаются, как правило, внутри клубка;
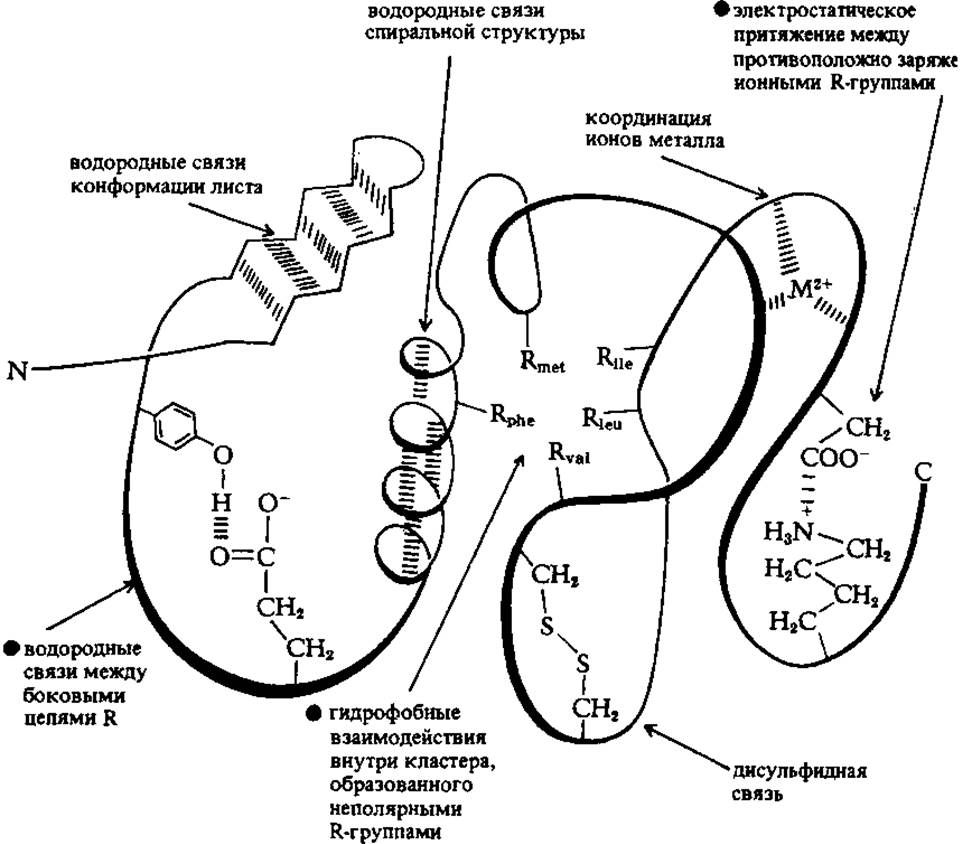
Рис. 2.3 Схема межмолекулярных взаимодействий в молекулах белков, стабилизирующих их пространственную (третичную) структуру (Рисунок позаимствован из книги: Бохински Р. Современные воззрения в биохимии. 1987.-М.: Мир.- 544 с.)