Принципы структурной организации белков - Г. Шульц 1982
Взаимодействия белок - лиганд
Центры связывания нуклеотидов
Индуцированное соответствие в аденилаткиназе
Индуцированное соответствие субстрата увеличивает специфичность. Многие ферменты, переносящие фосфорильные группы от АТР к акцепторным молекулам, используют механизм индуцированного соответствия для повышения своей специфичности, в частности для исключения Н2О как возможного акцептора фосфорильной группы. Типичным примером является аденилаткиназа (рис. 10.5), которая фосфорилирует Н2О в 105 раз медленнее, чем свой специфичный субстрат АМР.
Фермент, к которому применима модель индуцированного соответствия [686, 687], существует почти исключительно в неактивном состоянии Е. Только небольшая доля молекул имеет активную конформацию Е'. Согласно предположению Дженкса [631], отношение [Е]/[Е'] можно определить непосредственно по скоростям фосфорилирования Н2О и специфичного субстрата. Для аденилаткиназы величина [Е]/[Е'] в отсутствие субстрата должна быть равна 105. Присоединение специфичного субстрата вызывает изменение конформации активного центра, переводя таким образом фермент в активную форму Е' (рис. 10.5).
Большая часть связывающей энергии расходуется на изменение конформации фермента. Если предположение Дженкса верно, то наблюдаемая константа связывания Kнaбл = [E' — АМР]/[E] x [АМР] = 104 М-1 в 105 раз меньше, чем «общая» константа связывания Kобщ = [E' — АМР]/[E] ∙ [АМР]. Пользуясь соотношением ΔG = —RTlnK, мы находим, что общая свободная энергия связывания, т. е. полученная в результате взаимодействия АМР с ферментом Е' (ΔGобщ= —12,5 ккал/моль), более чем в два раза превышает свободную энергию связывания, следующую из наблюдаемой величины константы диссоциации (ΔGнабл= —5,3 ккал/моль). Таким образом, большая часть энергии связывания расходуется на обеспечение изменения конформации фермента от неактивной к активной форме, а оставшаяся часть проявляется в виде наблюдаемой энергии связывания. Общая энергия связывания была бы эквивалентна наблюдаемой энергии связывания в том случае, если бы фермент был заморожен в активной форме Е'. К сожалению, это можно осуществить только в кристаллической аденилаткиназе при условиях, в которых константы связывания определить нельзя [665, 688].
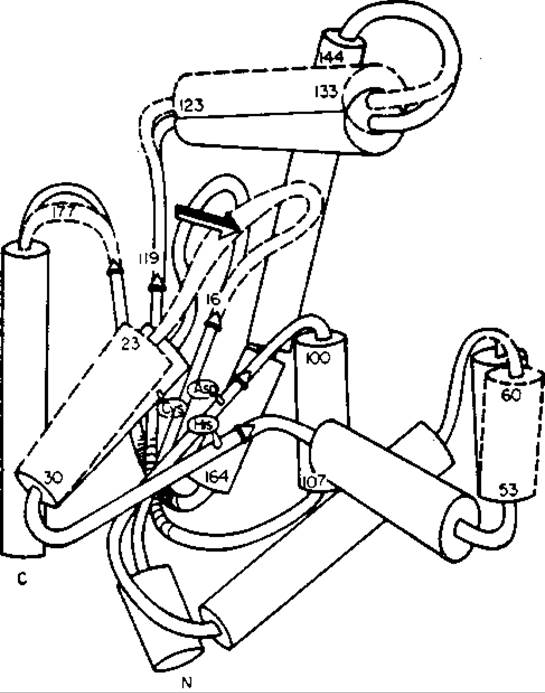
Рис. 10.5. Смещение фосфорилсвязывающей петли (остатки 16-22) при переходе из конформации А (показана сплошными линиями) в конформацию В (пунктирные линии) кристаллической аденилаткиназы [665, 688].
В конформации В в центре присоединения АТР имеются аденознновый карман, широкая «расщелина» для принятия фосфорильной группы, а также открытый центр присоединения АМР. В конформации А место присоединения также открыто, однако фосфорильная «расщелина» узка, а аденозиновый карман центра присоединения АМР закрыт. Эти данные показывают, что конформация В относится к свободному ферменту до индуцированного АМР соответствия, тогда как конформация А относится к ферменту Е' после такого изменения.