Принципы структурной организации белков - Г. Шульц 1982
Структурные основы механизма, действия и функции белков
Скелетная мышца - система, в которой действие белка можно связать с общей деятельностью органа
Отклик на нервные импульсы и гормональное действие в клетке мышцы
Отклик на нервные импульсы и гормональное действие в клетке мышцы
Когда клетка мышцы находится в состоянии покоя, центры прикрепления поперечных мостиков в тонких нитях блокированы молекулами тропомиозина [767—769], прочными двуволокнистыми образованиями [214]. Тропомиозин — прототип суперспирализованной а-спирали (разд. 5.2) с длиной молекулы 400 А, прикрывает семь глобулярных звеньев актина [768, 769]. Такое расположение тропомиозина, по-видимому, определяется тропонином, или, более точно, общей конформацией комплекса тропонина, свободного от Са2+ (рис. 11.6).
Цепочка событий, приводящих к смещению тропомиозина, начинается на клеточной мембране. Когда нервные импульсы активируют клетку мышцы, имеющую объем 1 мкл, ионы Са2+ выделяются из саркоплазматического ретикулума [770] в цитоплазму, где концентрация свободных ионов Са2+ становится на два порядка выше 1 мкм (рис. 11.7). Это приводит к насыщению тропонина С — кальций-чувствительного компонента тонкой нити [771]; к молекулам тропонина С присоединяются 90% из общего количества 1014 ионов. Связывание Са2+ вызывает конформационные изменения всего тропонинового комплекса [772]. При измененной структуре тропонина тропомиозин уже не может больше удерживаться в «выключенном» состоянии. Тропомиозиновая спираль соскальзывает в сторону к новому положению ближе к центру желоба. Таким образом, одна молекула тропомиозина освобождает семь мономеров актина, способных к взаимодействию с миозином [767, 769, 785].
Активация сократительного аппарата ионами Са2+ — модель-кооперативного процесса [772, 773]. Активация сократительного аппарата ионами Са2+ (рис. 11.7) хорошо иллюстрирует кооперативное поведение [92, 678, 682, 774] и аллостерический контроль [92, 681, 775, 776] в белках. При кооперативных действиях компонент белка или надмолекулярных образований, например тонких нитей» осуществляется переход из одного стабильного состояния («выключенное») в другое («включенное»). Типичным «переключающим» процессом внутри структурных единиц, например в компонентах тропонина, является конформационный переход. Эта структурна» изомеризация в свою очередь вызывается специфическим аллостерическим лигандом, ь нашем случае ионом Са2+. Поведение тропомиозина показывает, что не все динамические взаимодействия белок — белок основаны на структурной изомеризации в пределах отдельных белков; тропомиозин проявляет свое действие, смещаясь как молекула в целом (рис. 11.6).
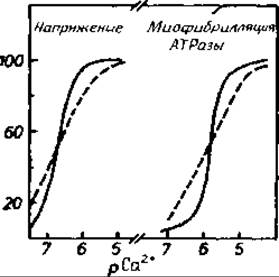
Рис. 11.7. Влияние концентрации ионов Са2+ на напряжение мышцы и АТРазную активность миозина [785].
рСа+ является понятием, аналогичным pH. Наблюдаемая кооперативность (сплошные линии), по-видимому, отражает тот факт, что структурные и ферментативные переходы в сократительном аппарате «включаются» при присоединении четвертого иона Са2+ к тропонину С [615, 773, 785]. Пунктирными кривыми показана гипотетическая активность сократительного аппарата при отсутствии структурной кооперативности.
Метаболические, нервные и гормональные раздражения, часто усиленные ферментативными каскадами, коррелируют расход и запас энергии. Какие механизмы обеспечивают химической энергией активную сократительную систему? Важную роль в непосредственной корреляции запаса энергии с энергетическими запросами играет ADP — основной продукт АТРазной деятельности миозина. ADP как метаболический сигнал приводит в действие выработку АТР активированными белками в ключевых положениях гликолитического пути и окислительного фосфорилирования [19]. Создание запаса энергии на продолжительный период регулируется ионами Са2+, которые стимулируют разложение гликогена [777]. Однако в этом случае механизм активации кальцием включает несколько стадий в отличие от одностадийной активации этим же ионом сократительного аппарата (рис. 11.1).
На мобилизацию гликогена может влиять гормон эпинефрин, который действует независимо или параллельно со стимуляцией нервными импульсами. Каскад мембранных и цитоплазматических процессов, которые ведут от связывания эпинефрина к фосфорилированию глюкозных фрагментов гликогена, функционирует как высоко эффективный механизм кинетического усилия (табл. 11.1). Концентрация гормона во внеклеточном пространстве составляет приблизительно 10-11 М; циклический АМР, который образуется из АТР — первого эффектора гормонального действия, активирует при концентрациях уже от 10-8 до 10-7 М белок киназу. Затем происходит 10-кратное усиление при стимуляции фосфорилазы 6 киназы, и заключительное усиление в 20 : 50 раз достигается при превращении фосфорилазы b в фосфорилазу а.
По аналогии с событиями, происходящими в мышце, можно полагать, что и в других физиологических процессах действие циклического АМР, второго передаточного звена для многих гормонов, связано с модуляцией системы реакций фосфорилирования — дефосфорилирования белков [777, 778].
Быстрая диссоциация комплексов кальций — белок служит меданизмом переключения активности белка. Рассмотрим теперь внутриклеточные процессы, происходящие после того, как прекращается действие раздражения (нервных импульсов или присоединения гормонов). Метаболические процессы прекратятся с запаздыванием по времени порядка секунд после того, как содержание циклического АМР или ионов Са2+ понизится ниже критической величины (табл. 11.1). В отличие от этого сократительный аппарат выключается в интервале 10—20 мс путем удаления ионов кальция из тонких нитей. Скорость этого процесса свидетельствует об эффективности саркоплазматического ретикулума как кальциевого насоса [701]. С другой стороны, наличие этой сложной системы, которая предназначена исключительно для поглощения и освобождения ионов Са2+, позволяет предположить, что ионам Са2+ присущи уникальные свойства в отношении функций переключения. На это указывает также тот факт, что ионы Са2+ принимают участие во многих других физиологических процессах в качестве посредников между поступающими раздражениями и клеточными реакциями [615], например, в светочувствительных клетках [779] или в яйцеклетке, где Са2+-зависимый механизм, по-видимому, обеспечивает оплодотворение только одной клеткой спермы [780]. Всем этим процессам свойственно быстрое включение и выключение активности белка. Это же относится и к сократительному аппарату: быстрое сокращение и быстрое расслабление необходимы при многих движениях.
По-видимому, кальций был эволюционно отобран для контроля быстрых биологических процессов из-за свойств его координационных соединений [615], которые при биологических условиях способны распадаться с приемлемыми скоростями [781]. В пусковой системе, основанной на сигнальной молекуле S и молекуле-мишени Т, ассоциация и диссоциация происходят в соответствии с уравнением
![]()
где k+1 и k-1 — соответственно константы
скорости образования и распада комплекса. Константа стабильности (константа ассоциации) равна К = k+1/k-1 = [ST]/]S] ∙ [Т]. Оптимальное значение для системы запуска, действующей в физиологически значимом интервале концентраций, варьирует от 105 до107 м-1 [782]. Величина k+1 для замещения Са2+ в воде составляет 108 М-1 ∙ с-1, а для Mg2+ 105 М-1∙ с-1 [762]. Отсюда величина k-1 = k+1/K имеет порядок 1000 в секунду в случае комплексов Са2+ и 1 в секунду в случае комплексов Mg2+. Кратчайшие периоды полураспада ![]() кальциевых и магниевых комплексов составляют при этих условиях соответственно 0,7 мс и 0,7 с.
кальциевых и магниевых комплексов составляют при этих условиях соответственно 0,7 мс и 0,7 с.
Таким образом, в отличие от ионов Mg2+ и других возможных биологических активаторов ионы Са2+ могут наилучшим образом осуществлять функцию включение — выключение независимо от того, имеет ли время действия белка порядок секунд или миллисекунд.
И наконец, следует подчеркнуть, что, по-видимому, именно биохимические процессы в координационных соединениях кальция ограничивают скорость контроля в мышцах позвоночных. Быстродействующие наружные мышцы человеческого глаза совершают до 50 циклов сокращения — расслабления в секунду. С другой стороны, маховые мышцы крылатых насекомых могут колебаться с частотой (в звуковом диапазоне) свыше 1000 Гц. Столь быстрые колебания основаны на таких процессах в белках, в которых ионы Са2+ участия не принимают, в частности на реакции АТРазы миозина на сжатие [783, 784].