Принципы структурной организации белков - Г. Шульц 1982
Ковалентная структура белков
Модификации главной цепи, контролируемые ферментами
Активация трипсиногена
Трипсиноген превращается в трипсин, который в свою очередь активирует многие другие ферменты. Во многих системах специфические протеазы не были обнаружены. Типичным примером достаточно подробно изученного процесса ограниченного протеолиза является активация в пищеварительном тракте зимогенов [1, 138, 139], неактивных предшественников ферментов [143]. Ключевым пищеварительным ферментом считается протеаза трипсин [1], не только ввиду его собственной активности по отношению к перевариваемому белку, но и потому, что он является единственным активатором других зимогенов, в частности химотрипсиногенов, прокарбоксипептидазы, проэластазы и профосфолипазы А. Сам трипсин выделяется в двенадцатиперстной кишке в виде неактивного предшественника трипсиногена (рис. 4.5).
Активатор трипсиногена узнает специфическую последовательность. Физиологический активатор трипсиногена — энтеропептидаза (называемая также энтерокиназой) находится на поверхности мембраны эпителиальных клеток в двенадцатиперстной кишке. Исключительно узкую специфичность энтеропептидазы характеризует тот факт, что этот фермент не гидролизует ни одной связи ни в одном из исследованных нативных или денатурированных белков, кроме единственной связи в трипсиногене (или в синтетических пептидах), которая находится перед последовательностью Asp-Asp-Asp-Asp-Lys (Нейрат, частное сообщение, а также [138]). Таким образом, этот фермент специфичен для последовательности, но не для третичной структуры.
![]()
Рис. 4.5. Аминокислотная последовательность протрипсиногена собаки (предварительные данные [153]).
Предполагается, что концевой аминокислотой всех образующихся полипептидных цепей эукариот служит Met (который затем отделяется). Пока не ясно, какой из остатков протрипсиногена, 16 или 17, отвечает N-концевой аминокислоте трипсиногена собаки. Использованный метод не позволяет различить остатки Leu и Не (например, в положении 24).
Если пренебречь поправочными факторами, учитывающими природное содержание отдельных аминокислот [144, 145], последовательность Asp-Asp-Asp-Asp-Lys встречается один раз на 205 комбинаций. Это показывает, что уникальная аминокислотная последовательность более надежна в качестве места специфичного опознания белка, чем какая-либо уникальная особенность третичной структуры, а Надежность весьма существенна для любого инициатора ферментативного каскада.
Активация трипсиногена характерна для других систем. Система трипсиноген — энтеропептидаза представляет собой, по-видимому, типичную систему специфического протеолиза (табл. 4.2) в следующих аспектах:
а) в большинстве случаев трансформация (пробелок → белок) может быть осуществлена трипсином in vitro, однако с относительно низкой скоростью и с относительно низкой специфичностью [146]. Следует подчеркнуть, что активный трипсин встречается in vivo только в двенадцатиперстной кишке.
б) Фермент, ответственный за превращение in vivo, более эффективен и более специфичен; каждая из приведенных в табл. 4.2 реакций, по-видимому, требует отдельного фермента. Можно ожидать, что, как и энтеропептидаза, специфичные протеазы могут узнавать не только основной остаток, но более широкое структурное звено (такое, как последовательность Asp-Asp-Asp-Asp-Lys в трипсиногене).
в) Специфичные протеазы часто присоединены к мембранам. Действие комплемента — результат защитной системы пробелков «Комплемент» — это часть защитной системы организма, которая устраняет клетки, например бактерии или раковые клетки. Сам комплемент построен по меньшей мере из 18 различных плазменных белков [147]. В функциональном отношении большинство из этих белков представляет пробелки (зимогены), поскольку они являются предшественниками последовательно или одновременно действующих ферментов, т. е. усилительного ферментативного каскада. Вся система комплемента со всеми ее компонентами в оптимальных концентрациях всегда готова к действиям и может быть запущена в любое время. В соответствии с назначением (осуществлять защиту и запускать многих предшественников активных белков) комплемент включает и систему свертывания крови [148].
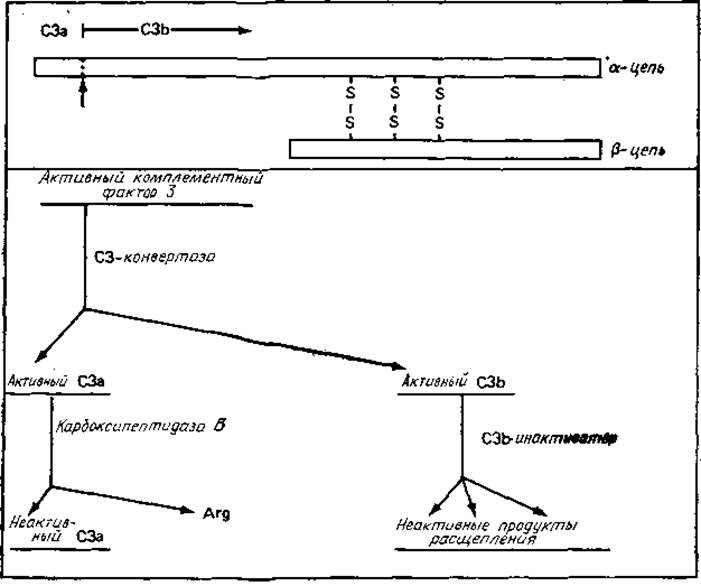
Рис. 4.6. Многообразные функции белка С3 комплемента и продуктов его расщепления [147].
Точка расщепления С3 конвертазой С3 отмечена стрелкой, направленной вверх. С3 (М 180 000) участвует в «пропердиновом (альтернативном) пути», а также является физиологическим предшественником двух активных ферментов, малого С3а и большого С3b. С3а участвует в реакциях возбуждения, а С3b представляет субъединицу или модулятор четырех различных ферментов комплемента. Следует отметить, что в основе инактивации С3а и С3b также лежит ограниченный протеолиз.
Протеолитический запуск имеет физиологические преимущества. На молекулярном уровне белки комплемента демонстрируют многие особенности специфических протеолитических процессов [138].
а) Подобно отдельным протеолитическим реакциям, протекающим количественно и необратимо, весь процесс комплемента может идти только в одном направлении.
б) Активация и инактивация белков, т. е. быстрые изменения активированных центров присоединения, накладывают жесткие ограничения во времени и пространстве; поэтому действие комплемента ограничивается ближайшим окружением иммуноглобулинов, которые прикрепляются к инородным клеткам.
в) Как данный белок, так и продукты его расщепления могут выполнять физиологические функции; специфический протеолиз все эти функции подавляет. Это видно на примере фактора С3 комплемента (рис. 4.6).
г) Действие комплемента включает морфогенетический аспект. Серия специфических протеолитических реакций приводит к агрегированию, в результате которого пять различных растворимых белков присоединяются к мембране [147].