Принципы структурной организации белков - Г. Шульц 1982
Ковалентная структура белков
Контролируемые ферментами модификации боковых цепей
Поперечные связи на основе модифицированных остатков Lys
Образование ε-(у-глутамил)лизиновых звеньев* существенно, например, при свертывании спермы грызунов в процессе ее ферментативной коагуляции [158] или крови при стабилизации хрупких фибриновых агрегатов [159]. Поперечные связи между полипептидными цепями в эластине (рис. 4.7) и в коллагене (рис. 4.4) также образованы боковыми цепями лизиновых остатков. В эластине, резиноподобном белке, поперечные связи, по- видимому, важны для обеспечения возврата волокон эластина в их исходное состояние после растяжения. Поперечные связи между молекулами коллагена способствуют устойчивости тройной спирали; эта структура термолабильна и расплавляется в желатин приблизительно при 40°С [125, 127]. Таким образом, внутри- и межмолекулярные поперечные связи между полипептидными цепями в коллагене предохраняют этот наиболее часто встречающийся в организме человека белок от превращения в аморфную желатину при температуре приближающейся к 40°С, когда человек болен. Во всех упомянутых выше белках поперечные ковалентные связи существенны для стабилизации, но не для образования белковых структур — особенность, которая свойственна и некоторым дисульфидным мостикам (разд. 4.2).
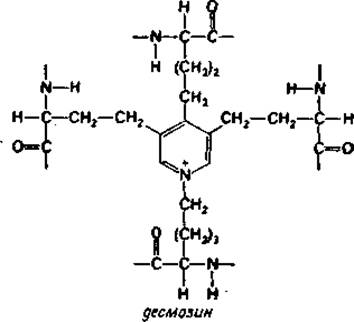
Рис. 4.7. Десмозин, образованный за счет объединения четырех боковых цепей остатков лизина; встречается в эластине.
* В соответствии с номенклатурой рис. 1.1, ξ-(δ-глютамил)лизин.
Таблица 4.3 Примеры модификаций боковых цепей
|
Модификация |
Модифицируемые боковые цепи |
Один конкретный, необязательно типичный пример |
Функциональный аспект |
|
Аденилирование [168] |
Туr |
Глутаминсинтетаза |
Аденилированием одного Туг на субъединицу фермент переводится из формы, в которой его биосинтетическая активность зависит от Mg2+(оптимально pH 7,6), в форму, зависящую от Мn2+ (оптимально pH 6,5) |
|
ADP-рибоксилирование [169] |
Lys или Arg |
Фактор элонгации EF2 |
Эта модификация катализируется дифтерийным ферментом [165], подавляет биосинтез и приводит к гибели клетки |
|
Карбоксилирование [170, 171] |
Glu |
Протромбин и другие кровосвертывающие факторы (VII, IX, X) |
Модифицированные остатки глутаминовой кислоты необходимы для нормального связывания Са2+ протромбином, т. е. для осуществляемого через Са2+ присоединения протромбина к фосфолипидным поверхностям |
|
Глюкоэилирование [172, 173] |
Asn, Thr, Ser |
Коэролоплазмин |
Потеря концевого звена карбогидрата в боковых цепях сывороточных гликопротеинов — сигнал к поглощению и разложению этих белков в печени |
|
Гидроксилирование [125, 127] |
Pro, Lys |
Коллаген |
Ухудшение гидроксилирования препятствует созреванию коллагена; в этом состоит молекулярная сущность цинги |
|
Метилирование [174] |
Asp, Gln, His, Lys, Arg |
ε-N-Метиллизин в ответвлении белка |
Несмотря на широкую распространенность этих реакций, примеров, Доказывающих прямую взаимосвязь между метилированием белка и определенной функцией, нет |
|
Фосфорилирование [175] |
Ser, Thr |
Фосфорилаза |
Неактивная фосфорилаза b превращается в активную фосфорилазу а путем фосфорилировании определенного остатка серина каждой субъединицы |