Принципы структурной организации белков - Г. Шульц 1982
Способы свертывания и ассоциации полипептидных цепей
Сверхвторичные структуры
Суперспирализация а-спиралей
В предыдущих главах были рассмотрены упорядоченные участки основной цепи белка, образующие энергетически предпочтительную вторичную структуру. Следующий, более высокий уровень сложности занимают ансамбли взаимодействующих между собой вторичных структур. Пространственное строение таких агрегатов, так называемую сверхвторичную структуру, предсказать трудно*. Их можно выделить лишь в том случае, если они достаточно часто встречаются в белках. Сам факт возникновения таких структур указывает на то, что они либо предпочтительны с точки зрения кинетики процесса свертывания, либо имеют энергетическую предпочтительность в уже свернутом белке.
В своей наиболее упорядоченной форме суперспирализованная ас-спираль встречается в фибриллярных белках. Хорошим примером сверхвторичной структуры является суперспирализованная а-спираль, постулированная Криком [210]. В этой структуре две а-спирали скручены друг относительно друга, образуя левую суперспираль с периодом идентичности около 140 Å (рис. 5.11, а). Суперспирализованные а-спирали обнаружены в фибриллярных белках а-кератине [211, 212], тропомиозине [213], парамиозине [214] и легкой цепи меромиозина [215]. Короткие участки такой сверхвторичной структуры наблюдались в глобулярных белках, содержащих а-спирали, упакованные приблизительно параллельно или антипараллельно. Наиболее известными примерами упаковки спиралей, приближающейся к линейной, являются гемеритрин [216, 217], белок оболочки вируса табачной мозаики [180, 218], бактериородопсин [219], оболочка бактериофага fd [220] и тирозил-тРНК-синтетаза [221].
* В более широком смысле определение сверхвторичной структуры должно охватывать и ß-складчатые листы, которые представляют собой ансамбли регулярных цепей. Однако обычно к сверхвторичной структуре относятся только системы регулярно расположенных в ß-листах пептидных цепей.
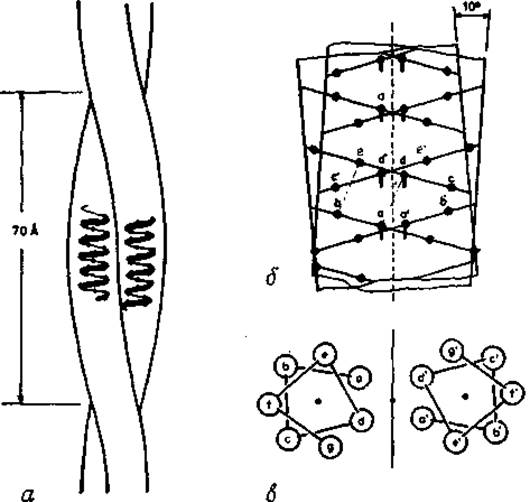
Рис. 5.11. Скрученная двухцепочечная а-спираль. а — общий вид левой двухцепочечной суперспирали с периодом идентичности 140 Показаны размеры отдельных а-спиралей. Обе спирали параллельны, б — суперпозиция цилиндрических диаграмм двух параллельных а-спиралей. Пунктиром показана центральная ось суперспирали. Ca-Атомы обозначены жирными точками. При наклоне в 10° все контакты aa', dd' и т. д. располагаются вдоль оси суперспиралн. Боковая цепь - d' и др. (обозначены короткими штрихами, указывающими противоположные спирали направления связей Са - Сβ) располагаются между боковыми цепями а, е, d и боковой цепью а следующего витка. Таким образом, все боковые цепи в областях контактов между a, d и т. д. и а', d' образуют плотную упаковку по типу выпуклость—впадина. в — сечение параллельной двухцепочечной а-спирали. Положения атомов Са обозначены в алфавитном порядке вдоль полипептидных цепей; положения а и а' находятся на одной высоте.
В суперспирали возможна плотная упаковка боковых цепей без существенных искажений а-спиралей. Структуру суперспирали можно представить путем наложения цилиндрических разверток двух соседних а-спиралей. Это может быть сделано таким образом (рис. 5.11, б), что образуется контактная линия, по которой осуществляются взаимодействия боковых цепей чередующихся остатков обеих спиралей. Такое взаимодействие может продолжаться беспрепятственно, если обе спирали образуют левую суперспираль с контактной линией в виде прямой оси. Шаг суперспирали можно определить с помощью контактной линии на одной из цилиндрических разверток, а именно по участку развертки, который отсекается двойным пересечением с ней контактной линии. При угле между а-спиралями около 10° (рис. 5.11, б) шаг составляет приблизительно 140 Ä. Значения углов (∅, ψ) несколько отклоняются от величин, отвечающих идеальной одиночной а-спирали. Повторяющейся структурной единицей в каждой цепи является гептапептид (рис. 5.11, в) — седьмой остаток оказывается в эквивалентном положении относительно оси суперспирали (рис. 5.11, б). Такая повторяемость в 7,0 остатка несколько меньше удвоенной высоты витка одиночной а-спирали (2∙3,6 = 7,2 остатка на виток). Если представить аминокислотную последовательность цепи формулой (abcdefg)m, то все остатки а (или соответственно b, с, d, е, f, g) будут находиться в структурно эквивалентных положениях (рис. 5.11, в).
Суперспирализация а-спирали энергетически выгодна, поскольку упаковка боковых цепей способствует образованию дополнительных благоприятных вандерваальсовых контактов между а-спиралями. Если взаимодействующие боковые цепи гидрофобии, то уменьшение свободной энергии такой структуры будет особенно эффективным, поскольку, располагаясь вдоль оси суперспирали, в этом случае боковые цепи экранированы от контактов с молекулами растворителя. Действительно в тропомиозине [222] и а-кератине [212], аминокислотные последовательности которых известны, положения a и d внутри суперспирали заняты гидрофобными остатками (рис. 5.11, в). Полярные остатки обычно располагаются на внешней поверхности, в положениях b, с и f. В тропомиозине положения e и g часто заняты заряженными остатками, которые образуют солевые мостики с находящимися напротив остатками g' и е’ соответственно.
Модель сверхспирали пригодна как для параллельных, так и для антипараллельных ас-спиралей. Все приведенные выше соображения отвечают параллельным и анти параллельным а-спиралям. Однако способу упаковки, приведенному на рис. 5.11,6, удовлетворяет только параллельное расположение; поскольку связь Са—Сβ а-спирального остатка не перпендикулярна оси а-спирали, а ориентирована под углом около 45° в направлении, обратном ходу спирали, то боковые цепи имеют ту же ориентацию. Они хорошо совмещаются только в случае параллельных спиралей (рис. 5.11, в). Для антипараллельных спиралей система совмещения будет выглядеть несколько иначе, чем показанная на рис. 5.11, б. Для устранения стерических отталкиваний между боковыми цепями требуется относительный сдвиг спиралей вдоль контактной линии примерно на 1 Å. Если, например, инвертировать показанную на рис. 5.11, в спираль с остатками abсde, отталкивания между боковыми цепями остатков a и d' устраняются при перемещении спирали на 1 Å вниз. Происходящее при этом сближение боковых цепей остатков а' и d не приведет к стерическим затруднениям, так как эти цепи направлены в противоположные стороны. Таким образом, ни одно из направлений спирали, по-видимому, не является предпочтительным.
С помощью химических данных, а также результатов рентгеноструктурного анализа и электронной микроскопии было показано, что в тропомиозине [213, 223, 224] и в легком меромиозине [215] а-спирали параллельны. По-видимому, это относится и к а-кератину, поскольку длинная цепь а-кератина может быть полностью синтезирована и стабилизирована, прежде чем сможет образоваться суперспираль из антипараллельных а-спиралей. Напротив, в глобулярных белках гемеритрине [216, 217] и оболочке вируса табачной мозаики [180, 218] упаковка спиралей антипараллельна.
Были предложены три другие предпочтительные относительные ориентации с различными контактами между двумя а-спиралями [225]. Они получены из рассмотрения цилиндрических разверток и также соответствуют благоприятной упаковке боковых цепей. Однако они пока еще не подкреплены надежно экспериментальными данными.