Принципы структурной организации белков - Г. Шульц 1982
Аминокислоты
Свойства боковых цепей
Канонические аминокислоты отличаются только боковыми цепями. Каждая боковая цепь настолько специфична, что ее нелегко заменить какой-либо другой. Ниже будут рассмотрены свойства всех стандартных боковых цепей.
Gly увеличивает подвижность основной цепи. Это уникальная аминокислота, которая лишена боковой цепи и поэтому не проявляет асимметрии при Са-атоме. Отсутствие боковой цепи позволяет остаткам Gly принимать необычные двугранные углы (рис. 2.3, a), что приводит к изгибам основной цепи. Кроме того, остатки Gly могут способствовать образованию плотной упаковки цепи белковой молекулы. Вероятно, по этим причинам остаток Gly практически не замещался в процессе эволюции.
В боковой цепи аланина находится одна метальная группа. Это небольшой неполярный остаток, не имеющий какой-либо особой предрасположенности находиться внутри или на поверхности белка. Ala — самая распространенная аминокислота, по-видимoму, из-за ее простоты и доступности. Проще можно получить только Gly. Однако содержание Gly в цепи ограниченно: его избыток привел бы к чрезмерной лабильности основной цепи.
Жесткость разветвленных боковых цепей. Неполярные боковые цепи валина, изолейцина и лейцина разветвлены. Разветвление крупных боковых цепей определяет их ограниченную внутреннюю подвижность. Остаток Val содержит разветвление при Сβ-атоме; его Сy-метильные группы стерически взаимодействуют с главной цепью, уменьшая ее подвижность. Остаток Не также разветвлен при Cβ-атоме, причем ветви различаются между собой. Поэтому Сβ в Ilе является дополнительным асимметрическим центром. Так как все биологические реакции стереоспецифичны, используется только один стереоизомер (рис. 1.2,6). Присутствие Ilе делает главную цепь более жесткой, как и присутствие Val. В случае Leu не возникает особых стерических взаимодействий с основной цепью, поскольку разветвление боковой цепи в этой аминокислоте находится при атоме Су. Жесткие боковые цепи легче фиксируются в определенном положении; понижение энтропии ∆Sцепипри этом не так велико (разд. 3.5), что способствует свертыванию цепи.
Все ароматические остатки содержат одно разделяющее метиленовое звено. Фенилаланин несет самую большую полностью неполярную боковую цепь. Как и в трех других ароматических боковых цепях, в этом случае между Са и ароматическим кольцом имеется Сβ-метиленовая группа. Даже при наличии метиленовой группы подвижность боковой цепи заметно ограничена; без разделяющей метиленовой группы ароматическое кольцо создавало бы серьезные стерические затруднения при Са-атоме и главная цепь оказалась бы слишком жесткой. Полностью неполярный пролин является весьма специфическим остатком, поскольку его боковая цепь ковалентно связана с основной цепью. В результате образуется почти жесткая структура, в которой возможны только незначительные искажения цикла. Кроме того, пролин фиксирует двугранный угол вращения вокруг связи между Са и пептидным азотом в узком интервале ± 20°.
Триптофан имеет самую объемную боковую цепь. Его небольшая полярность обусловлена наличием гетероциклического индольного цикла. Довольно подвижная боковая цепь метионина содержит один атом серы в тиоэфирной группе, что приводит к появлению дипольного момента. Все самые крупные неполярные остатки: Val, Ile, Leu, Phe, Pro, Trp и в меньшей степени Met — располагаются преимущественно внутри белковых молекул.
Полярные боковые цепи образуют водородные связи. Типичными полярными и нейтральными боковыми цепями обладают цистеин, серин, треонин, аспарагин, глутамин и тирозин. Из них Cys выполняет особую роль, поскольку он способен образовывать поперечные мостики (цистины) между различными частями основной цепи путем присоединения к другому остатку Cys (разд. 4.2). Остатки Ser и Thr несут гидроксильные группы, которые могут образовывать водородные связи. В Thr, имеющем асимметрический Сβ-атом, активным является только один стереоизомер (рис. 1.2,6). Несущие амидные группы аспарагин и глутамин также способны к образованию водородных связей, причем амидные группы функционируют в качестве доноров водорода, а карбонильные — в качестве акцепторов. По сравнению с аспарагином у глутамина имеется лишнее метиленовое звено, придающее полярной группе большую подвижность и ослабляющее ее взаимодействие с основной цепью. Полярная гидроксильная группа Тук, для которой рК = 10,1 может диссоциировать при высоких значениях pH. Поэтому Тук до некоторой степени аналогичен заряженной группе: образованные им водородные связи довольно прочны. Нейтральные полярные остатки могут располагаться как на поверхности, так и внутри белковых молекул. Находясь внутри, они обычно образуют водородные связи между собой или с полипептидным остовом (разд. 3.6).
His подходит для каталитических целей. Гистидин содержит гетероциклическую ароматическую боковую цепь, для которой рК = 6,0 (табл. 1.1). В физиологическом интервале pH его имидазольное кольцо может либо оставаться незаряженным, либо присоединять ион Н+ из раствора. Поскольку такое присоединение происходит достаточно легко, гистидин может выполнять роль катализатора химических реакций. Установлено, что он присутствует в большинстве активных центров ферментов.
Заряженные боковые цепи обычно находятся на поверхности молекул. Остатки аспарагиновой и глутаминовой кислот при физиологических значениях pH отрицательно заряжены. Из-за короткой боковой цепи карбоксильная группа Asp довольно жестко фиксирована относительно главной цепи. Это может быть причиной того, что карбоксильные группы активных центров принадлежат главным образом остаткам Asp, а не Glu. Как правило, оба остатка находятся на поверхности белков.
Большая часть положительно заряженных остатков лизина и. аргинина также находится на поверхности белковых молекул. Эти длинные и гибкие остатки обычно не имеют строго фиксированной конформации. Весьма подвижные в окружающей среде, они повышают растворимость белковых глобул. Однако в некоторых, случаях боковые цепи Lys и Arg участвуют в образовании внутренних солевых мостиков, а также способствуют катализу. Благодаря своему расположению на поверхности остатки Lys и Arg чаще других подвергаются воздействию ферментов, которые либо модифицируют их боковые цепи, либо расщепляют полипептидную цепь, со стороны карбонильного углерода (разд. 4.3).
Гидрофобность зависит от площади контактной поверхности и числа диполей. Как указано в гл. 3 и 8, процесс свертывания полипептидной цепи зависит от гидрофобности (неполярности) боковых цепей, поскольку образование гидрофобного ядра глобулы, по-видимому, является одной из основных движущих сил свертывания. Козман [15] и позднее Носаки и Танфорд [16] определили эту гидрофобность путем измерения изменения свободной энергии при переносе аминокислот из воды в органические растворители. Чтобы получить разность свободных энергий ∆Gперенос для боковой цепи, необходимо вычесть вклад главной цепи. Это можно сделать путем вычитания значения для Gly. Результаты приведены в табл. 1.1.
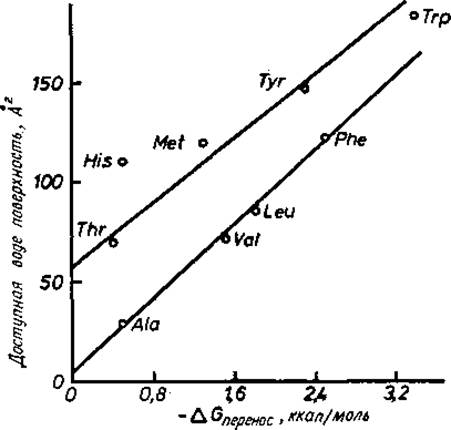
Рис. 1.8. Доступная воде поверхность [17] боковой цепи аминокислоты как функция ее гидрофобности [16], т. е. как функция свободной энергии переноса из воды в этанол или диоксан, которые по предположению имитируют условия во внутренней области белка. Доступная воде поверхность определена на рис. 1.9.
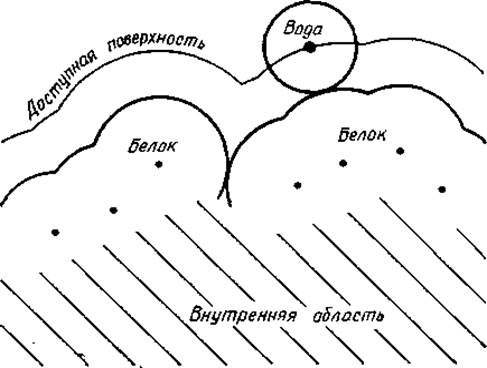
Рис. 1.9. Доступная воде поверхность белка (или боковой цепи).
Поверхность белка описывается огибающей вандерваальсовых радиусов атомов, находящихся на поверхности (обозначены точками). Внутренняя область белка заштрихована. Молекулы воды представляются в виде сфер радиусом 1,4 Å. «Доступная воде поверхность» определяется как площадь, описываемая центром молекулы воды при ее скольжении по вандерваальсовой поверхности белка (или боковой цепи). Отметим, что в щелях существуют недоступные молекулам воды области белка (или боковой цепи).
Как показал Чотна [17] (рис. 1.8), для полностью неполярных боковых цепей существует линейная зависимость между ∆Gпepeнoc и площадью поверхности, доступной воде. Площадь доступной воде поверхности определена на рис. 1.9. Аналогичная зависимость, но с уменьшением ∆Gпepeнос примерно на 1,5 ккал/моль найдена для остатков, содержащих один диполь, например Ser, Thr, Met, Туr и Trp (разд. 3.5). Положение Тrр на рис. 1.8 показывает, что индольный цикл представляет собой слабый диполь. Диполь Met, по-видимому, является более сильным. Это подтверждено обнаружением двух водородных связей с Met-180 в химотрипсине [18].