Принципы структурной организации белков - Г. Шульц 1982
Модели, изображение и документация белковых структур
Данные о строении белка
Ковалентное строение
Во многих случаях известно только ковалентное или только пространственное строения белка. Сведения о структуре белка могут включать известную аминокислотную последовательность (ковалентную структуру), известную трехмерную (геометрическую) структуру или все эти данные одновременно. В настоящее время известно значительно больше ковалентных структур, чем пространственных. С другой стороны, имеется более десятка геометрических структур, аминокислотные последовательности которых пока еще не установлены [80, 124, 217, 221, 236, 261, 303, 306, 307, 310, 313, 316]. Все расшифрованные ковалентные структуры приводятся в Атласе аминокислотных последовательностей и структур белков [20]. Данные об известных пространственных структурах сведены в табл. 5.2.
Поскольку белки состоят из линейных полипептидных цепей, документация ковалентной структуры проста: ее можно изобразить линейной последовательностью аминокислотных остатков, записанных сокращенно в виде однобуквенных символов (табл. 1.1). Такую запись легко читать. Для удобства каждому остатку присваивается порядковый номер вдоль цепи.
Обычно для последовательностей гомологичных белков используется одинаковая нумерация. Запись гомологичных последовательностей несет значительно больше информации, если она выполнена в виде единой схемы, как это представлено на рис. 7.1, а. Здесь для всех последовательностей используется одинаковая нумерация, что возможно, однако, лишь в том случае, если допустимы пропуски аминокислот — делеции. Трудности возникают тогда, когда при последующих исследованиях обнаруживают гомологичные последовательности, содержащие один или более дополнительных остатков. Публикуя эти данные, обычно сохраняют установленную схему нумерации, а дополнительным остаткам приписывают номера предыдущих остатков (например, 27) с буквами в алфавитном порядке (например, 27А, 27В, ...). Каждые несколько лет в Атласе аминокислотных последовательностей и структур белков [145] производится перенумерация всех последовательностей и дополнительные позиции становятся узаконенными. Однако изменение привычной нумерации остатков приводит к значительным неудобствам при чтении и записи белковых структур. По-видимому, было бы более целесообразно после очередного изменения нумерации сохранять все схемы нумерации неизменными в течение значительного периода времени, например 10 лет.
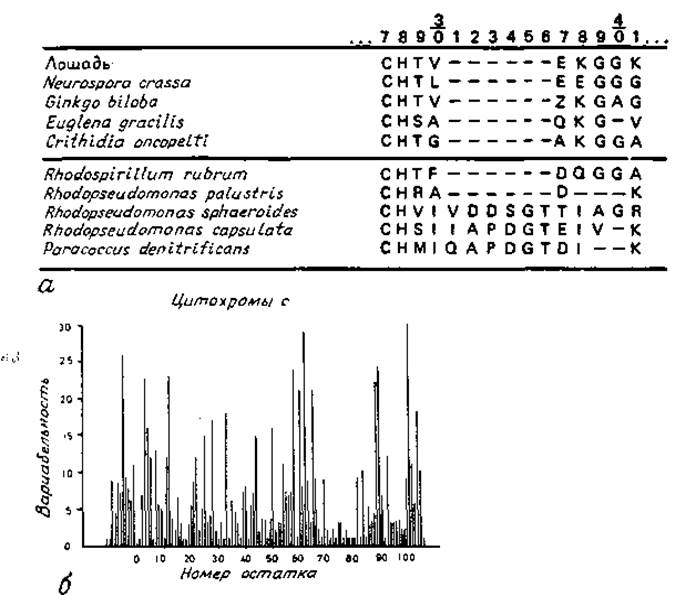
Рис. 7.1. Представление аминокислотных последовательностей.
а — сопоставление положений остатков 27—41 в последовательностях нескольких цитохромов с [145]. Прочерки означают пропуски (делеции). б — гистограмма вариабельности последовательностей цитохрома с [408]. Вариабельность определяется числом различных аминокислот, встречающихся в данном положении, отнесенным к частоте появлення обычно наблюдаемой в этом положении аминокислоты.
Малая частота замен остатков в данном положении указывает на структурную и функциональную важность этого положения. Сопоставление структур родственных белков показывает, что чувствительность данного положения в последовательности к замене аминокислот резко различается. Это наблюдение иллюстрируется на рис. 7.1, б. Высокая частота замен в определенном положении свидетельствует о том, что остаток в этом положении не очень существен для структуры или функции белка. Поскольку большинство замен происходит на поверхности белка, характер такой структурной вариабельности может дать также некоторую информацию о том, где находится данный остаток, на поверхности или внутри белка. Это полезно в тех случаях, когда пространственная структура белка еще не известна.
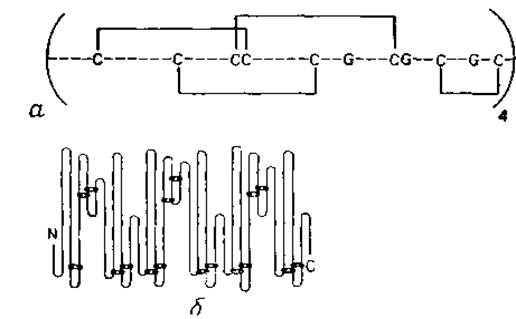
Рис. 7.2. Представление дисульфидных связей в белках. а — система связей S—S в агглютинине зерна пшеницы, повторяющаяся четыре раза ъ одной полипептидной цепи. Инвариантные остатки Gly выделены. Четыре одинаковые пространственные формы обнаружены также в трехмерной структуре [316]. б — система связей S—S в альбумине из сыворотки человека [409]. Связи повторяются, но не очень точно; аминокислотная последовательность также обнаруживает повторяющиеся участки. Трехмерная структура белка еще не известна.
Расположение дисульфидных мостиков выявляет эволюционные связи. Многие белки, в частности внеклеточные, содержат дисульфидные мостики, ковалентно связывающие удаленные части полипептидной цепи. Способы изображения таких связей показаны на рис. 7.2. Мостики S—S обнаруживают тенденцию сохраняться в процессе эволюции, поэтому они характерны для данного семейства гомологичных последовательностей. Более того, по дисульфидным мостикам можно выделить структурные повторения в одной цепи, как в случае агглютинина пшеничного зерна (рис. 7.2, а), строение которого было выяснено по карте электронной плотности, так и сывороточного альбумина человека (рис. 7.2, б), строение которого установлено химическими методами.