Принципы структурной организации белков - Г. Шульц 1982
Эволюция белков
Специализация белков
Вероятность мутаций аминокислотных остатков
Вероятность фиксированных мутаций зависит от типа остатка.
Вероятности мутаций для различных остатков приведены в табл. 9.2. Значения, находящиеся на диагонали, представляют вероятность того, что данный остаток будет сохраняться. Ser, который часто находится на поверхности белка, имеет наименьший диагональный член, что означает наибольшую вероятность мутации. Наименьшая вероятность мутации соответствует Тrр. Это вполне объяснимо, поскольку Тrр обычно является внутренним остатком и его трудно заместить остатком с боковой цепью равной величины.
Сильный консерватизм в этом отношении обнаруживают также некоторые остатки Gly. На первый взгляд это до некоторой степени неожиданно, поскольку Gly не несет боковой цепи, которая могла бы выполнять определенную функцию. Однако анализ трехмерной структуры белков показал, что для таких инвариантных положений Gly (как, например, в положении контакта между спиралями В и Е в семействе глобинов [145, 277] или в положении 7 рис. 7.8 между двумя а-спиралями цитохромов с-типа [495]) именно отсутствие боковой цепи имеет решающее значение. Только в этом случае спирали могут упаковываться достаточно плотно; введение боковой цепи привело бы к уменьшению плотности упаковки, а следовательно, и стабильности (разд. 3.6). Инвариантные остатки Gly были обнаружены также в третьем положении в шести реверсивных поворотах цепи типа II у белков семейства цитохрома с [495]. Как видно из рис. 5.7, б, боковая цепь в этом положении невозможна по стерическим причинам.
Эволюционный путь, начинающийся от случайного набора частот встречаемости аминокислот, приводит к установлению существующих частот встречаемости. Как показали Кинг и Джукс, данные которых иллюстрируются на рис. 9.1, а, существует строгая корреляция между наблюдаемыми частотами встречаемости аминокислот и теми, которые можно ожидать при применении существующего генетического кода (рис. 1.5, б) к случайным нуклеотидным последовательностям в ДНК [144]. Эта корреляция явно указывает на случайность замен аминокислот, что подтверждает гипотезу эволюции, выдвигаемую «нейтралистами» [496]. Можно ли согласовать эти данные с установленным фактом консервативности замен аминокислот, т. е. с тем, что эволюция белка в значительной степени определяется отбором? По-видимому, можно.
Роль консервативных изменений хорошо видна из матрицы вероятности мутаций, приведенной в табл. 9.2. Элементы этой матрицы весьма неоднородны, что согласуется с большими различиями в тенденциях аминокислот к заменам. Однако более подробный анализ этой матрицы показывает, что наблюдаемое число мутаций, приводящих к данному остатку (последняя колонка) коррелирует также с частотой встречаемости этой аминокислоты, ожидаемой из случайных последовательностей ДНК (рис. 9.1, б). Таким образом, имеется соответствие между рис. 9.1, а и 9.1, б, т. е. тип остатка с высокой наблюдаемой частотой встречаемости имеет высокую вероятность появления в результате мутации. Поэтому любой эволюционный путь, начинающийся от данного (случайного) набора частот встречаемости аминокислот, изменяется (т. е. модифицируется в соответствии с матрицей вероятности мутаций) таким образом, чтобы приблизиться к наблюдающемуся в настоящее время набору частот встречаемости аминокислот.
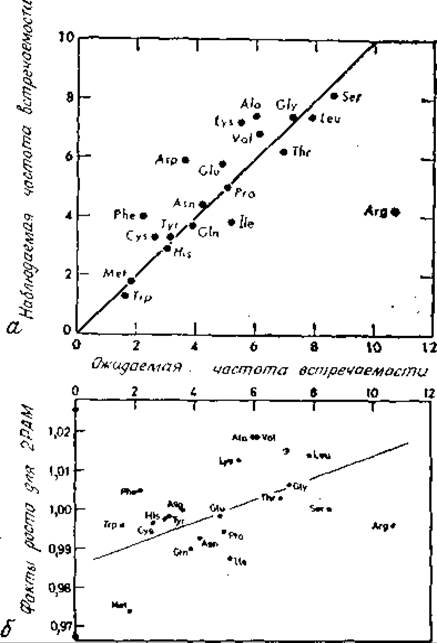
Рис. 9.1. Частоты встречаемости аминокислот.
a — корреляция между наблюдаемой и ожидаемой частотами встречаемости аминокислот. Наблюдаемая частота встречаемости аминокислот получена по 53 полностью установленным аминокислотным последовательностям белков млекопитающих [144]. Ожидаемые частоты встречаемости рассчитаны по случайным последовательностям ДНК с помощью генетического кода [144]. Обе частоты встречаемости даны в процентах к общему аминокислотному составу. Ход прямой указывает на приблизительное равенство ожидаемых и наблюдаемых величии, б — корреляция между суммой значений, образующих строку табл. 9.2, и ожидаемой частотой встречаемости, определенной согласно рис. а. Эта сумма представляет фактор роста данной аминокислоты на эволюционном расстоянии в 2 РАМ. Таким образом, если в данном наборе белков Ala имеет частоту встречаемости 1%, за 2 РАМ она возрастет до 1,019%. Фактор роста приводит к достижению корреляции, показанной на рис. а, после значительных эволюционных изменений любого исходного соотношения аминокислот. Следовательно, корреляцию, приведенную на рис. а, можно объяснить с помощью табл. 9.2 вероятности мутаций.
Итак, корреляцию на рис. 9.1, а можно объяснить с помощью матрицы вероятности мутаций. Корреляция выдерживается, хотя в каждом конкретном случае замены аминокислот находятся под сильным давлением отбора. Очевидно, что на основании корреляции между такими суммарными величинами, как частоты встречаемости аминокислот, невозможно заключить, что эволюция следовала нейтральному, т. е. недарвиновскому пути. Отметим, что корреляция, приведенная на рис. 9.1, б, пока еще никак не объяснена.