Принципы структурной организации белков - Г. Шульц 1982
Эволюция белков
Дифференциация белков
Построение филогенетического дерева для вазотоцина, скситоцина и вазопрессина
Процесс, в результате которого гомологичные белки наделяются различной функцией, называют процессом дифференциации белков [473]. В ферментах мутация в одном или двух положениях аминокислот может изменять субстратную специфичность белка [508]. Соответственно изменение предрасположенности к субстрату Sx в пользу субстрата Sy может привести к адаптации организма путем замещения фермента Ех на Еу. Экспериментально исследованы случаи такой адаптации в бактериях [519—524]. Хорошим примером является эволюция ацетамидазы в фенилацетамидазу [521] и рибитолдегидрогеназы в ксилитдегидрогеназу [508, 522]. В природе постоянно развиваются белки с новыми функциями. Это подтверждается эволюцией наследуемой сопротивляемости токсичным химическим веществам у насекомых и сопротивляемости антибиотикам у бактерий [519].
* Ma = mega-anni = миллион лет.
Обычно дифференциация белков начинается с дупликации соответствующего гена. Начиная с этого момента пути различных аминокислотных последовательностей расходятся в соответствии с различием функций. Классическим примером [522] дифференциации белков служит наличие нескольких цепей глобинов, например миоглобина и a-, ß-, у-, ε- и ζ-цепи гемоглобина человека.
При сравнении гомологичных белков, выполняющих разные функции, не предполагают и действительно часто не обнаруживают постоянства скорости фиксации аминокислотных замен. Это не создает больших помех при построении генеалогии белков, выполняющих различные функции, однако к датировке этапов эволюции на основе структурных сопоставлений таких белков нужно относиться с осторожностью.
В этом разделе рассматриваются генеалогические связи пептидных гормонов вазотоцина (ВТ), окситоцина (ОТ), бычьего вазопрессина (БВ) и свиного вазопрессина (СВ). Вазотоцин участвует в восстановлении и регуляции водно-солевого баланса многих позвоночных, окситоцин (млекопитающих) выполняет только первую, а вазопрессин — только вторую функцию. Эти гормоны, аминокислотная последовательность которых была определена в 1953 г. группой дю Виньё, представляют первый изученный пример дифференциации пептидов [145, 526]. Кроме того, их небольшая величина позволяет проследить основные этапы построения филогенетического дерева гомологичных (поли)пептидов.
Исходным пунктом является упорядоченная матрица различий.
Первый этап состоит в построении для этих гормонов матрицы случайных и упорядоченных различий, показанной на рис. 9.3. При последующем уточнении эту матрицу превращают в матрицу «минимальных замен оснований» (МЗО)* в последовательностях, которую вновь упорядочивают. Введение шкалы МЗО приводит к увеличению составляющих матрицу элементов, так как более 33% наиболее часто встречающихся аминокислотных замен несовместимы с однократной заменой нуклеотида (см. рис. 9.11 из работы [203]). Это до некоторой степени повышает и точность, потому что в случае двойных и тройных нуклеотидных замен возможны более одной фиксированной аминокислотной замены в данном положении. Кроме того, многократные нуклеотидные замены могут соответствовать консервативным остаткам, замена которых может быть зафиксирована только в результате многократного нуклеотидного обмена. Таким образом, используемая шкала МЗО придает большие веса заменам в строго консервативных положениях.
* Возражения против использования шкалы МЗО при сравнении отдаленно родственных белков обсуждаются в работе [509].
Необходимо установить топологическую взаимосвязь между молекулярными видами. Перед построением филогенетического дерева в нашем примере нужно установить топологическую взаимосвязь между четырьмя видами пептидов. Это можно сделать графическим путем, как показано на рис. 9.3, г. Здесь однократные замены оснований отмечены крестиками, так что при переходе от одного вида молекул (например, СВ) к другому виду (например, ОТ) крестики, складываясь, дают элемент матрицы МЗО (например, 3). Если применить тот же подход, но воспользоваться матрицей аминокислотных замен, то для рассмотренного примера мы не получим решения, даже осли расположить молекулы в виде топологического графа (рис. 9.3, г).
Более подробный анализ показывает, что проблема подгонки матрицы различий к топологическому графу соответствует системе шести линейных уравнений (шесть элементов матрицы, приведенной на рис. 9.3, в) и только пяти неизвестным (число крестиков в каждой ветви), которая имеет решения только в специальных случаях. В нашем случае мы получаем прямое решение матрицы МЗО для одной из трех возможных топологий. Можно применить и матрицу аминокислотных различий, если предположить, что мутация в ветви ОТ происходит в том же месте, что и мутация ветви СВ, т. е. при переходе от СВ к ОТ происходят три замены, хотя в матрице различий имеется только две.
Топологическую взаимосвязь можно превратить в филогенетическое дерево. Исходя из существующих молекулярных видов, нужно разместить предшественников в точках разветвлений. Точку разветвления выбирают таким образом, чтобы числа замен во всех ветвях до существующих видов были по возможности близкими. В нашем примере обе точки разветвления а и |3 в этом отношении эквивалентны (рис. 9.3), что приводит к выбору БВ и ВТ в качестве соответствующих предшественников. Если, однако, обратиться к организмам, то вопрос будет решен в пользу ВТ, поскольку он встречается в более древних таксонах [145]. С помощью дерева можно также установить, что аминокислотная последовательность бычьего вазопрессина (БВ) имеет более древнее происхождение, чем последовательность свиного вазопрессина (СВ).
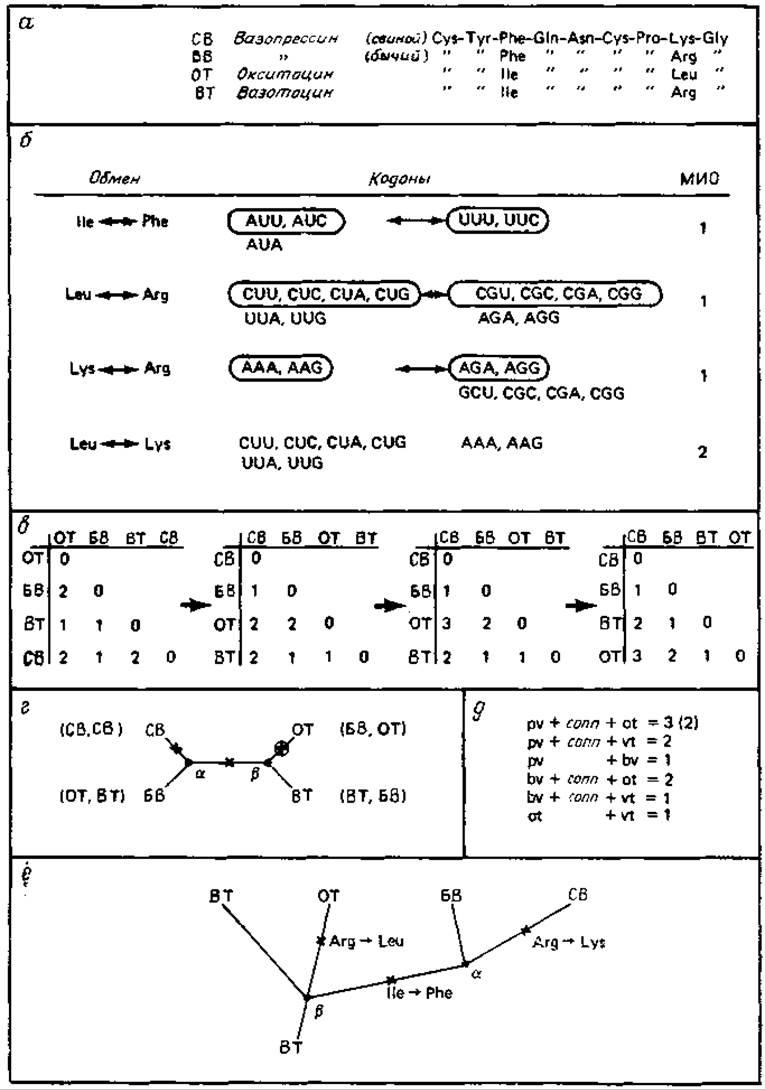
Рис. 9.3. Построение филогенетического дерева. а — аминокислотные последовательности четырех пептидных гормонов. Замены происходят только в двух положениях. б — замены аминокислот, соответствующие кодоны и минимальные изменения оснований (МИО). Кодоны, относящиеся к МИО-1 обведены. в — построение матрицы аминокислотных различий: отсутствие порядка упорядоченность → переход от аминокислотных различий к МИО → другой тип упорядоченности. г — топологическая взаимосвязь между четырьмя пептидными гормонами. В скобках даны другие варианты топологии. Узловые точки а и ß отвечают промежуточным, не обязательно существующим видам. Крестиками отмечены аминокислотные замены (или значения МИО) в соответствующих ответвлениях. Обведенный крестик представляет особый случай, когда происходит аминокислотная замена остатка, находящегося, как предполагается, в том же положении, где изменяется ветвь СВ—а. Следовательно, эта замена не означает перехода СВ—ОТ матрицы аминокислотных различий, д — система из шести линейных уравнений, отвечающая топологии, данной в г. pv означает число крестиков в ветви СВ—a, conn — число крестиков в ветви а—ß и т. д. Система имеет решение, если первое уравнение приравнено 3, а не 2, т. е. если рассматривать аминокислотную замену в том же положении. При другой топологии решения нет. е — филогенетическое древо, построенное по топологии рис. г.
Отметим, что этот метод дает сведения об аминокислотной последовательности предшественников в точках разветвления. Именно этот этап является основным в упоминавшемся выше «методе предшествующих последовательностей». При сравнении более чем четырех (поли)пептидов в общем случае точного решения получить нельзя. В таких случаях, в частности, например, для цитохрома с (70 специализированных белков) и для сериновых протеаз (20 дифференцированных белков, см. ниже), метод предшествующих последовательностей [513] используется для достижения возможно лучшей подгонки при построении на основе имеющихся данных наилучшего филогенетического дерева. Очевидно, что в таком дереве будет наблюдаться тем больше неопределенностей в некой предшествующей последовательности, чем более удалена во времени точка разветвления.