БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.15. Критически необходимые остатки в последовательности аминокислот
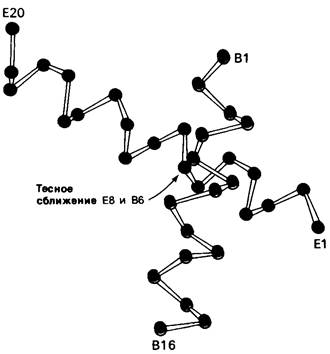
К настоящему времени расшифрованы последовательности аминокислот в гемоглобинах более чем 20 видов животных (от миноги до человека). Полученные данные выявили значительное разнообразие аминокислот в большинстве положений. Есть, однако, 9 положений в последовательности, где стоят одни и те же аминокислоты у всех или почти всех обследованных видов (табл. 3.2). Эти консервативные (инвариантные) положения имеют особо важное значение для функции гемоглобина. Некоторые из них входят в состав непосредственно участка связывания кислорода. К числу других консервативных положений относится тирозин-НС2, который стабилизирует молекулу, образуя водородную связь между спиралями Н и F. Глицин (В6) сохраняется благодаря своему небольшому размеру: боковая цепь более крупная, чем 1 атом водорода, препятствовала бы сближению спиралей В и Е (рис. 3.27); пролин-С2 имеет важное значение, так как им завершается спираль С.
Таблица 3.2. Консервативные аминокислотные остатки в гемоглобине

Значительную вариабельность проявляют неполярные остатки внутренней части молекулы гемоглобина. Однако во всех случаях - это замена одного неполярного остатка на другой, также неполярный (например, аланина на изолейцин). Таким образом, выраженный неполярный характер внутренней части молекулы сохраняется неизменным. Как было указано выше, в обратимом оксигенировании гема важную роль играет его расположение в неполярной нише, где он защищен от воды. Кроме того, наличие внутренней неполярной сердцевины (core) в молекуле гемоглобина стабилизирует его пространственную структуру.
Рис. 3.27. Перекрест цепей В и Е в миоглобине. В положении В6 практически всегда стоит глицин, поскольку для более длинной, чем у глицина, боковой цепи нет места
Остатки аминокислот на поверхности молекулы крайне вариабельны. В самом деле, очень немногие из них имеют устойчивый положительный или отрицательный заряд. Казалось бы, остатки пролина должны проявлять постоянство, поскольку ими завершаются участки спирализации. Однако это не так. Инвариантен только один пролиновый остаток, и в то же время во всех миоглобинах соответствующие длины и направления спиралей практически одинаковы. Очевидно, существуют другие пути терминирования и изгиба α-спиралей.
3.16. Возникновение гемоглобина — новый этап в эволюции
До сих пор мы акцентировали внимание на структурном сходстве между миоглобином и гемоглобином. Однако функционально эти две молекулы совершенно различны. Субъединицы гемоглобина имеют ту же конфигурацию, что и миоглобин. Но соединение субъединиц с образованием тетрамера α2β2 приводит к появлению новых свойств огромного биологического значения. Этому вопросу посвящена следующая глава.