БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 4. ГЕМОГЛОБИН: АЛЛОСТЕРИЧЕСКИЙ БЕЛОК
4.14. Бисфосфоглицерат снижает сродство к кислороду путем образования перекрестных связей с дезоксигемоглобином
БФГ специфически связывается с дезоксигемоглобином в соотношении 1 БФГ на 1 тетрамер гемоглобина. Это очень интересная стехиометрия. Казалось бы, белок, имеющий структуру α2β2, должен обладать по крайней мере двумя участками связывания какого бы то ни было небольшого соединения. Наличие только одного участка связывания тотчас же наводит на мысль, что БФГ связывается по оси симметрии молекулы гемоглобина в центральной полости, где сходятся 4 субъединицы (рис. 4.19). Участок связывания БФГ образован положительно заряженными остатками, принадлежащими обеим β-цепям, а именно: α-аминогруппой, лизином ЕF6 и гистидином Н21. Очевидно, что эти группы легко взаимодействуют с отрицательно заряженным БФГ, имеющим при физиологическом значении pH почти 4 отрицательных заряда. Стереохимически БФГ комплементарен констелляции из 6 положительно заряженных групп β-цепей, обращенных к внутренней полости молекулы гемоглобина (рис. 4.20). Более слабое связывание БФГ гемоглобином плода по сравнению с гемоглобином А объясняется тем, что у гемоглобина плода в положении Н21 находится серин, а не гистидин.
Рис. 4.19. Участок связывания бисфосфоглицерата в центральном углублении молекулы дезоксигемоглобина
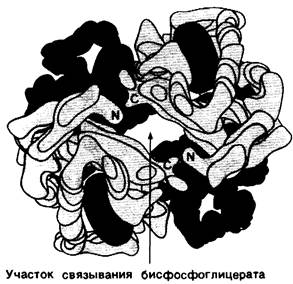
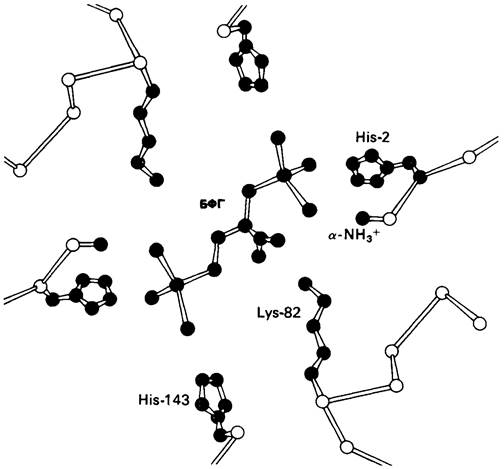
Рис. 4.20. Способ связи БФГ с дезоксигемоглобином человека. Бисфосфоглицерат взаимодействует с тремя положительно заряженными группами в каждой β-цепи
При оксигенировании БФГ отщепляется, поскольку центральная полость становится слишком мала. В частности, сужается промежуток между Н-спиралями р!!!-цепей. Кроме того, расстояние между α-аминогруппа- ми возрастает с 16 до 20 А, вследствие чего исчезает контакт между ними и фосфатными группами БФГ.
Теперь нам понятно, почему БФГ снижает сродство к кислороду. Образуя перекрестные связи с β-цепями, БФГ стабилизирует четвертичную структуру дезоксигемоглобина, Другими словами, БФГ сдвигает равновесие в сторону Т-формы. Как уже упоминалось, в дезоксигемоглобине имеется 8 солевых связей, заякоривающих его концевые карбоксильные остатки. Для того чтобы произошло оксигенирование, эти солевые связи необходимо разорвать. Присоединение БФГ создает дополнительные солевые связи, которые должны быть разорваны. В итоге сродство гемоглобина к кислороду при присоединении БФГ оказывается сниженным.
4.15. СО 2 присоединяется к концевым аминогруппам гемоглобина, снижая его сродство к кислороду
У аэробных организмов на одну молекулу потребленного O2 образуется примерно 0,8 молекулы СO2. Большая часть СO2 транспортируется кровью в виде бикарбоната, который образуется в эритроцитах под действием карбоангидразы:
CO2 + H2O⇄ HCO3- - + H+.
Значительная часть Н+, высвобождающегося в этой реакции, присоединяется к дезоксигемоглобину и таким образом участвует в эффекте Бора. Кроме того, СO2транспортируется гемоглобином в форме карбамата. В основе этого процесса лежит обратимая реакция между находящимися в неионизированной форме α-аминогруппами гемоглобина и СО2:
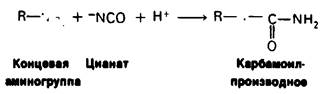
R—NН2 + СO2 ⇄ R—NYCOO- + Н+
Связанные карбаматы образуют солевые мостики, которые стабилизируют Т-форму. Отсюда следует, что присоединение СО2 снижает сродство гемоглобина к кислороду. И наоборот, СO2 более прочно связывается с дезоксигемоглобином, чем с оксигемоглобином.
4.16. Механизм эффекта Бора
Каким образом гемоглобин связывает протоны при своем превращении из окси- в дезоксиформу? Очевидно, при этом превращении должно возрастать сродство определенных участков к Н+. В частности, при превращении из окси- в дезоксиформу должно увеличиваться значение рК отдельных групп, поскольку увеличение рК означает более сильное связывание Н+. Гемоглобин связывает около 0,5 Н+ в расчете на одну высвободившуюся молекулу O2. Это присоединение Н+ позволяет поддерживать постоянство pH в тканях с активным метаболизмом.
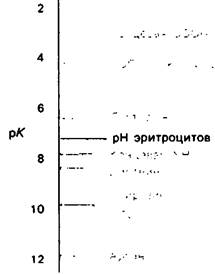
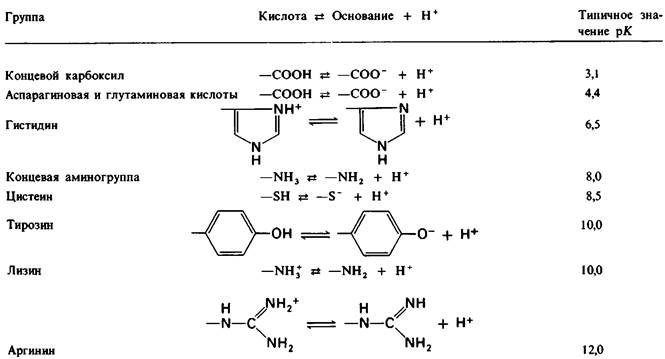
У каких конкретных групп повышается значение рК? Рассмотрим сначала возможные участки связывания Н+ в гемоглобине (рис. 4.21 и табл. 4.1) и затем сузим круг выбора. Значения рК карбоксильных групп боковой цепи глутамата и аспартата составляют обычно ~ 4. Маловероятно, что их рК возрастут до 7-8 - условие, необходимое для участия в эффекте Бора. Подобным же образом маловероятно, что значения рК боковых цепей тирозина, лизина и аргинина могут быть сдвинуты в достаточной мере, поскольку обычно их рК превышает 10. Отсюда следует, что эффект Бора может быть обеспечен участием гистидина, цистеина и концевой аминогруппы, так как нормальные значения рК этих групп лежат в области 7.
Рис. 4.21. Типичные величины рК кислотных групп белков. Окружение отдельной группы может изменить ее реальную величину рК в сторону повышения или понижения
Путем сопоставления данных химического и рентгеноструктурного анализа удалось идентифицировать специфические группы, ответственные за эффект Бора. Рентгеноструктурный анализ указывал на вовлечение в эффект Бора остатков гистидина, расположенных на С-конце каждой из β-цепей гемоглобина (гистидин-146β). Справедливость этого предположения была проверена следующим путем. Был получен гемоглобин, β-цепи которого не содержали гистидина-146. Этого удалось достичь путем использования карбоксипептидазы β-специфического протеолитического фермента, расщепляющего в некоторых полилептидных цепях пептидную связь, образованную концевой аминокислотой основного характера, расположенной на С-конце пептида, т. е. содержащей свободную карбоксильную группу. Такая модификация гемоглобина приводила к снижению эффекта Бора в два раза. Отсюда следует, что гистидин-146 обеих β-цепей вносит, по-видимому, основной вклад в эффект Бора.
Таблица 4.1. Значения pК ионизируемых групп в белках
Роль концевых аминогрупп гемоглобина в эффекте Бора была убедительно доказана следующим образом. Концевые аминогруппы модифицировали обработкой цианатом, приводящей к образованию карбамоилпроизводного, не способного более связывать Н+. Если карбамоилировали концевые аминогруппы только β-цепей, то эффект Бора сохранялся полностью. Если модификации подвергались концевые аминогруппы также и α-цепей, то эффект Бора существенно уменьшался.
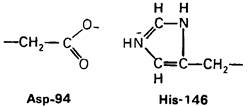
Рентгеноструктурный анализ дает конкретную картину участия этих групп в обеспечении эффекта Бора. В оксигемоглобине гистидин-146β свободно вращается, а в дезоксигемоглобине этот концевой остаток участвует в ряде взаимодействий. Особенно важное значение имеет взаимодействие имидазольного кольца этого гистидина с отрицательно заряженным аспартатом-94 в той же р-цепи. Непосредственная близость этой отрицательно заряженной группы повышает вероятность связывания протона гистидином (рис. 4.22). Другими словами, близость аспартата-94 повышает рК гистидина -146. Таким образом, при переходе от окси- к дезоксигемоглобину гистидин-146 приобретает большее сродство к Н+ вследствие локального изменения заряда в его непосредственном окружении.
Аналогичным образом изменяется при дезоксигенировании окружение концевых аминогрупп α-цепей. В оксигемоглобине эти группы свободны. В дезоксигемоглобине концевая аминогруппа одной α-цепи взаимодействует с концевой карбоксильной группой другой а-цепи. Близость отрицательно заряженного карбоксилированного остатка в дезоксигемоглобине повышает сродство этой концевой аминогруппы к Н+. Данные рентгеноструктурного анализа свидетельствуют о том, что в эффекте Бора участвует и третья группа, а именно гистидин-122 в α-цепи.
Рис. 4.22. Аспартат-94 повышает рК гистидина-146 в дезоксигемоглобине, но не в оксигемоглобине. Близость отрицательного заряда на аспартате-94 способствует протонированию гистидина-146 в дезоксигемоглобине
Итак, окружение трех пар групп, связывающих протоны (концевая аминогруппа и два гистидина) в окси- и дезоксигемоглобине неодинаково. В дезоксигемоглобине это локальное окружение заряжено более отрицательно. В результате при высвобождении кислорода эти группы связывают Н+.
4.17. Коммуникация внутри белковой молекулы
Как мы видели, связывание гемоглобином О2, Н+, СО2 и БФГ находится в определенной взаимосвязи. Эти молекулы присоединяются к пространственно разобщенным участкам, коммуникация между которыми опосредована конформационными изменениями внутри белка. Наличие раздельных участков связывания для этих молекул объясняется тем, что различна структура самих связываемых молекул. Взаимодействия между разными участками связывания опосредованы изменениями четвертичной структуры. В сущности, все известные аллостерические белки состоят из двух и более полипептидных цепей. Область контакта между двумя цепями способна усиливать и передавать конформационные сдвиги от одной субъединицы к другой. У аллостерического белка нет строго определенных свойств. Напротив, его функциональные свойства зависят от наличия в окружающей среде определенных молекул. Отсюда следует, что аллостерические взаимодействия имеют колоссальное значение для функции клеток. Таким образом, эволюционный переход от миоглобина к гемоглобину привел к появлению структуры, способной воспринимать информацию из окружающей среды.