БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 5. МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ: СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ
5.4. Получение пептидных карт: выявление аминокислотной замены в гемоглобине серповидных клеток
Итак, электрофоретический анализ показал, что гемоглобин S имеет 2-4 дополнительных положительных заряда по сравнению с гемоглобином А. Возможны разные пути возникновения такого различия в заряде молекулы:

Выяснение вопроса, какая конкретно замена произошла в гемоглобине S, относится к 1954 г., когда Вернон Ингрем (V.Ingrem) разработал новый метод определения аминокислотных замен в белках. Для проведения анализа молекулу гемоглобина расщепляли на фрагменты, поскольку в небольших пептидах, содержащих примерно по 20 аминокислот, выявить замену аминокислоты, безусловно, легче, чем в целой молекуле белка, значительно большей (в 10 раз) по размеру. Гемоглобин подвергали специфическому расщеплению трипсином по пептидным связям, образованным карбоксильными группами лизина и аргинина. Поскольку в αβ-половине гемоглобина содержится в общей сложности 27 остатков лизина и аргина, при триптическом гидролизе образовалось 28 разных пептидов. Следующий этап состоял в разделении полученных пептидов. Для этого был применен метод двумерного разделения (рис. 5.6). Смесь пептидов наносили в виде небольшого пятна в угол большого листа фильтровальной бумаги. Далее проводили электрофорез в одном направлении, разделяя таким образом пептиды в соответствии с их общим зарядом. Однако полного разделения смеси при этом не происходило. Многие пептиды накладывались друг на друга. Поэтому продолжали процесс разделения, но уже методом хроматографии на бумаге, причем это разделение проводили в направлении, перпендикулярном направлению электрофореза.
Рис. 5.6. Смесь пептидов разделяют путем электрофореза в горизонтальном направлении с последующей хроматографией в вертикальном направлении

X роматография -термин введен Михаилом Цветом в 1906 г. применительно к разделению смеси пигментов из листьев растения на колонке карбоната кальция. М. Цвет сравнил этот процесс с «разложением света на спектр».
Образовано от греческих слов chroma-цвет и graphein - рисовать, писать.
Процедура состояла в следующем: конец бумаги, ближайший к разделяемым пептидам, помещали в смесь органических растворителей и воды, налитую на дно герметично закрывающейся стеклянной банки. При этом растворитель поднимался вверх по бумаге. В такой ситуации каждый пептид мог либо мигрировать с растворителем (неполярная среда), либо оставаться на обводненной целлюлозе бумаги (высокополярная среда). Такой метод разделения называется распределительной хроматографией, Пептид с наиболее выраженными неполярными свойствами будет растворяться в растворителе и, следовательно, подниматься вместе с фронтом растворителя вверх по бумаге; в то же время самый полярный из пептидов останется на бумаге внизу. Рассматриваемые методы-хроматография на бумаге и электрофорез-дополняют друг друга, поскольку они разделяют пептиды на основе независимых свойств; первый-на основе различий в полярности, второй-на основе различий в общем заряде. Вся последовательность проведения анализа-избирательное расщепление белка на небольшие пептиды с их последующим разделением в двух направлениях-называется методом пептидных карт (отпечатков пальцев).
Получаемые в результате пептидные карты дают очень наглядный результат. После окрашивания нингидрином пятна пептидов становятся ясно видны. Сравнение карт гемоглобина А и гемоглобина S показало, что все их пептидные пятна идентичны, за исключением одного. Это пятно элюировали с каждой из пептидной карт и определили, что в обоих случаях оно соответствует пептиду из 8 аминокислот. При последующем аминокислотном анализе обнаружилось, что пептид гемоглобина S отличается от пептида гемоглобина А лишь по одной аминокислоте.
5.5. В β-цепи произошла замена одиой-единственной аминокислоты
α- и β-Цепи разделили методом ионообменной хроматографии. Далее получили их пептидные карты. Оказалось, что гемоглобин S отличается от гемоглобина А по β-цепи, в частности по N-концевому триптическому пептиду β-цепи. Определив аминокислотную последовательность этого пептида, Ингрем показал, что в β-цепи гемоглобина S в 6-м положении вместо глутамата стоит валин:
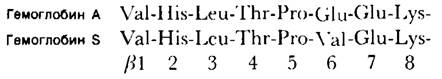
Рис. 5.7. Сравнение окрашенных нингидрином пептидных карт гемоглобина А и гемоглобина S. Красным кружком обведен пептид, по которому различаются эти гемоглобины