БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 5. МОЛЕКУЛЯРНЫЕ БОЛЕЗНИ: СЕРПОВИДНОКЛЕТОЧНАЯ АНЕМИЯ
5.9. Высокая частота гена серповидноклеточности обусловлена его защитным эффектом в отношении малярии
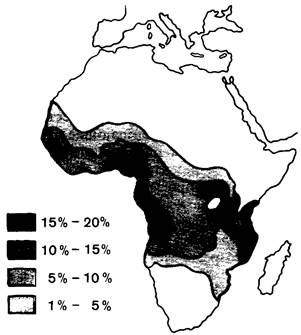
Частота гена серповидноклеточности в некоторых областях Африки достигает 40%. До последнего времени индивиды, гомозиготные по этому гену, погибали, не достигнув зрелости; из этого следует, что высокая частота этого гена в популяции могла сохраниться только под сильным давлением естественного отбора. Джеймс Нил (J. Neel) высказал предположение, что гетерозиготное состояние должно давать какие-то преимущества по сравнению с гомозиготным по нормальному либо по дефектному гену. И действительно, Антони Аллисон (A. Allison) обнаружил, что носительство признака серповидноклеточности служит защитой от заболевания наиболее тяжелой формой малярии, приводящей обычно к смертельному исходу. Выявлена отчетливая корреляция между распространением малярии и частотой гена серповидноклеточности в Африке (рис. 5.15). Описанный феномен представляет собой типичный случай сбалансированного полиморфизма: гетерозиготы устойчивы в отношении малярии и не страдают от серповидноклеточной анемии, тогда как люди, гомозиготные по нормальному аллелю, восприимчивы к малярии.
Рис. 5.15. Распространение гена серповидноклеточности в Африке. Высокая частота этого гена ограничена районами, где малярия является основной причиной смертности
5.10. Стратегия поиска лекарственных средств для лечения серповидноклеточной анемии
Сведения о молекулярном механизме возникновения серповидноклеточной анемии позволяют в настоящее время перейти к поиску специфических нетоксичных препаратов, предупреждающих или задерживающих развитие клинической картины заболевания. Поиски ведутся в трех направлениях. Одна группа перспективных средств-это вещества, тормозящие образование волокон из гемоглобина S. В качестве таких стереоспецифических ингибиторов гелеообразования проходят оценку синтетические олигопептиды, последовательность аминокислот в которых соответствует N-концевому участку βS-цепи и другим участкам контактов в молекуле гемоглобина S. Ко второй группе исследуемых веществ относятся соединения, повышающие сродство гемоглобина S к кислороду и тем самым снижающие концентрацию его дезоксиформы. Так, например, цианат проникает в эритроциты и повышает сродство гемоглобина к кислороду путем необратимого карбамоилирования а-аминогрупп. Гемоглобин быстро реагирует с цианатом, потому что НN=С=O(изоциановая кислота) в неионизированной форме является реакционно способным аналогом O=С=O. Вспомним, что концевые аминогруппы гемоглобина участвуют в обратимом связывании СO2 (разд. 4.15). На использование цианата в лечении серповидноклеточной анемии возлагались большие надежды, пока обширные клинические испытания не выявили его побочных токсических эффектов. Так, у некоторых больных при лечении цианатом развивалось поражение периферических нервов, обусловленное, вероятно, тем, что карбамоилированию подвергаются не только гемоглобин, но и другие белки. Сейчас ведется поиск менее токсичных модификаторов гемоглобина. Третий возможный подход к лечению серповидноклеточной анемии -снижение общей концентрации гемоглобина S в эритроцитах. Этого можно достичь, например, увеличением объема клетки. Поскольку скорость образования волокон из дезоксигемоглобина в очень большой степени зависит от его концентрации, даже незначительное увеличение объема эритроцита оказало бы выраженный лечебный эффект. Отсюда следует, что ионные насосы и каналы эритроцитарной мембраны-это те потенциальные мишени, на которые должно быть направлено действие терапевтических средств, используемых для лечения серповидноклеточной анемии.
5.11. Молекулярная патология гемоглобина
При обследовании больных с симптомами серповидноклеточной анемии, а также при проведении электрофоретического анализа гемоглобинов здоровых людей было обнаружено более 100 аномальных гемоглобинов. В северной Европе гетерозиготность по варианту гемоглобина А встречается у 1 человека из 300. Частота любого из мутантных аллелей обычно составляет менее 10-4; это на несколько порядков ниже, чем частота гена серповидноклеточности в районах, эндемичных по малярии. Другими словами, большинство аномальных гемоглобинов не дает организму никаких преимуществ в естественном отборе. Как правило, наличие аномальных гемоглобинов либо никак не влияет на здоровье человека, либо оказывается пагубным.
Различают несколько типов аномальных гемоглобинов.
1. Изменена наружная часть молекулы. Почти все замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S представляет собой поразительное исключение.
2. Изменен активный центр. В этом случае в дефектной субъединице не происходит
связывания кислорода, так как структурные изменения вблизи гема непосредственно влияют на связывание кислорода.
3. Изменена третичная структура. Замена аминокислот препятствует возникновению нормальной конформации молекулы. Такие гемоглобины обычно нестабильны.
4. Изменена четвертичная структура. Некоторые мутации, затрагивающие участки области контактов, приводят к потере аллостерических свойств. В результате нарушается сродство таких гемоглобинов к O2.
5.12. Гемоглобин М: продукт мутации в активном центре
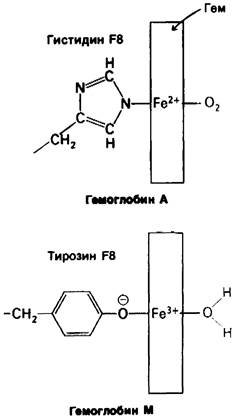
Замена проксимального или дистального гистидина в группе гема на тирозин приводит к стабилизации, окисленной (ферри) формы гема, не способной к связыванию кислорода (рис. 5.16). В этом случае ионизированная боковая цепь тирозина образует комплекс с окисленным железом гема. Указанная замена может произойти как в а-, так и в β-цепи. Действительно, были обнаружены все четыре мутантных варианта. Мутантные гемоглобины, у которых два гема в молекуле постоянно находятся в ферри- форме, называют гемоглобином М. Буква М указывает, что мутировавшие цепи находятся в форме метгемоглобина (ферригемоглобина). У людей с гемоглобином М обычно отмечается цианоз. Заболевание встречается только у гетерозиготных особей, поскольку гомозиготность по этому признаку почти всегда приводит к летальному исходу.
Рис. 5.16. Замена проксимального гистидина (F8) тирозином приводит к образованию гемоглобина М. Отрицательно заряженный атом кислорода тирозина связывается с атомом железа, находящимся в ферри- форме. В шестое координационное положение встает вода, а не O2
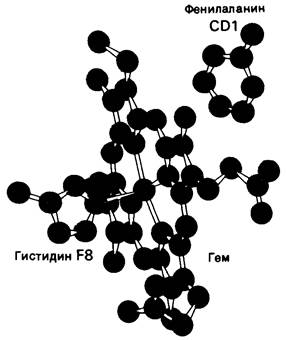
5.13. Полярные группы в щели, занимаемой гемом, ослабляют его связывание с полипептидной цепью
Еще один тип мутации, затрагивающей активный центр, выражается в том, что в щели, занимаемой гемом, на место неполярной группы становится полярная. Между гемом и полипептидной цепью существует 60 межатомных контактов, причем эти контакты по своей природе неполярны. Поскольку эти неполярные взаимодействия устойчиво сохраняются в нормальных гемоглобинах разных видов животных, можно думать, что большинство из них имеет существенное значение для функционирования молекулы гемоглобина. В самом деле, мутации в участках связывания гема почти всегда приводят к неблагоприятным последствиям. Рассмотрим для примера гемоглобин Hammersmith. На месте фенилаланина CD1 (рис. 5.17) в этом гемоглобине находится серин. В результате такой замены нарушается связывание гема. Объяснить это можно следующим путем: вероятно, наличие полярного остатка серина способствует тому, что в щель, обычно занимаемую гемом, проникает вода.
Рис. 5.17. Локализация фенилаланина СD1, одного из инвариантных остатков в гемоглобине. Ароматическое кольцо этого фенилаланина находится в контакте с гемом