БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 6. ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ
6.25. Присутствие воды ослабляет полярные взаимодействия
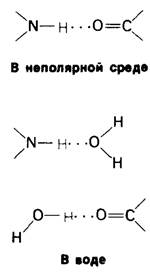
Полярность молекул и способность к образованию водородных связей делает воду высокоактивным соединением. Это проявляется в том, что вода ослабляет электростатические взаимодействия и водородные связи, возникающие между другими соединениями. При этих полярных взаимодействиях вода ведет себя как очень сильный конкурент. Рассмотрим, например, как действует вода на образование водородной связи между карбонильной и амидной группами (рис. 6.29). Водородные атомы воды способны заместить NН-группу в качестве донора, а кислородный атом воды - кислород СО-группы в качестве акцептора водорода. Следовательно, образование сильной водородной связи между СО- и NН-группами возможно только в отсутствие воды.
Рис. 6.29. Вода ведет себя как конкурент при образовании водородных связей
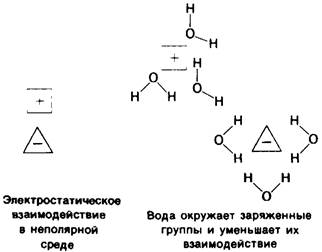
Сила электростатических взаимодействий в воде по сравнению с вакуумом снижена в 80 раз (80-диэлектрическая постоянная воды). Высокая диэлектрическая постоянная воды отражает такие свойства, как полярность и способность образовывать вокруг ионов ориентированную сольватную оболочку, которая ослабляет электростатическое взаимодействие одного иона с другим (рис. 6.30). Такие ориентированные сольватные оболочки создают собственное электрическое поле, противоположное по знаку полю, созданному ионом. В результате способность ионов, окруженных сольватными оболочками, к электростатическим взаимодействиям оказывается заметно ослабленной. Вода характеризуется исключительно высокой диэлектрической постоянной.
Рис. 6.30. Вода ослабляет электростатическое взаимодействие заряженных групп
6.26. Гидрофобные взаимодействия; в водной среде неполярные группы стремятся ассоциировать
Каждый знает, как мелкие капельки масла в воде соединяются в одну большую каплю. Аналогичный процесс происходит и на уровне атомов, а именно неполярные молекулы или группы в водной среде объединяются в кластеры. Этот процесс ассоциации обусловлен гидрофобными взаимодействиями. Фигурально выражаясь, вода прижимает неполярные соединения друг к другу.
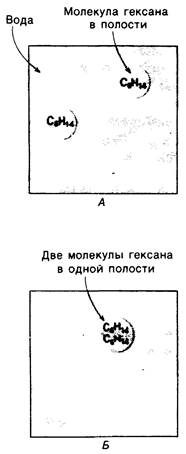
Гидрофобные взаимодействия играют решающую роль в складывании макромолекул, в связывании субстратов с ферментами и во многих других молекулярных процессах. Рассмотрим, что лежит в их основе. Допустим, что в воду вносится молекула неполярного соединения, например, гексана. В воде при этом образуется полость, из-за чего на какой-то момент разрываются водородные связи между молекулами воды. Далее сдвинутые со своих мест молекулы воды переориентируются и образуют максимально возможное число новых водородных связей. Этого, однако, удается достичь лишь за определенную «плату»: возможностей образования благоприятных водородных связей в решетке воды вокруг молекул гексана значительно меньше, чем в чистой воде. В результате молекулы воды вокруг молекулы гексана располагаются гораздо более упорядоченным образом, чем в остальных частях раствора, а это означает, что энтропия раствора снижается. Посмотрим теперь, что произойдет, если в воде окажутся две молекулы гексана. Будут ли они находиться в двух малых полостях (рис. 6.31, А) или же в одной большой полости (рис. 6.31, Б)? Опыт показывает, что две молекулы гексана объединяются и занимают одну большую полость. Это объединение происходит в результате высвобождения отдельных ориентированных молекул воды, окружающих разделенные молекулы гексана. Следовательно, в основе гидрофобного взаимодействия лежит увеличение энтропии, обусловленное возрастанием степеней свободы высвобожденных молекул воды. Таким образом, неполярные молекулы в воде объединяются друг с другом не в силу высокого взаимного сродства, а прежде всего вследствие существования прочных связей между молекулами воды.
Рис. 6.31. Схематическое изображение двух молекул гексана в небольшом объеме воды. А-молекулы гексана занимают различные полости в структуре воды. Б -молекулы гексана занимают одну общую полость, что энергетически более выгодно