БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 10. ВВЕДЕНИЕ В ПРОБЛЕМУ БИОЛОГИЧЕСКИХ МЕМБРАН
10.8. Реконструкция функционирующих мембранных систем из очищенных компонентов
Большое множество мембранных белков было солюбилизировано и получено в очищенном виде (см. гл. 34-37). Некоторые из них сохраняют активность в растворе с детергентом. Например, фоторецепторный белок родопсин дает одну и ту же полосу поглощения 500 нм независимо от того, находится ли он в растворе детергента или же в составе мембраны сетчатки. Более того, в обоих случаях простетическая группа этого белка при освещении претерпевает одинаковые структурные изменения. Белок саркоплазматического ретикулума мышц калсеквестрин, связывающий кальций, сохраняет способность связывать кальций и вне мембраны. Из саркоплазматического ретикулума был выделен также кальциевый насос (фермент Са2 + -АТРаза). Оказалось, что из смеси фосфолипида и белка кальциевого насоса могут образоваться функционально активные пузырьки, способные накапливать Са2+ в присутствии АТР как источника энергии. Реконструкция функционально активных мембранных систем из очищенных компонентов - надежный подход к изучению мембранных процессов.
10.9. Отдельные белки мембран глубоко погружены в липидный бислой
Некоторые мембранные белки удается выделить методами мягкой обработки, например, экстрагированием раствором высокой ионной силы (например, 1 М NаСl). Другие белки оказываются более прочно связанными с мембраной - их можно отделить лишь с помощью детергента (рис. 10.17) или органического растворителя. Исходя из различий в прочности связи с мембраной, соответствующие белки подразделяют на периферические и интегральные (рис. 10.18). Интегральные белки образуют многочисленные связи с углеводородными цепями мембранных липидов, и потому их можно выделить только с помощью агентов, конкурентно участвующих в этих неполярных взаимодействиях. Периферические белки, напротив, связаны с мембранами электростатическими силами и водородными связями. Эти полярные взаимодействия могут быть разрушены при добавлении солей или изменении pH. Согласно последним данным, периферические белки мембран в большинстве случаев присоединяются к поверхности интегральных белков.
Рис. 10.17. Структуры детергентов, используемых для солюбилизации и очистки мембранных белков
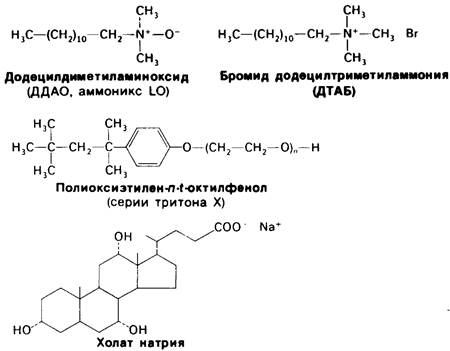
Рис. 10.18. Интегральные белки (а, б, в) мембраны образуют большое число связей с углеводородными цепями бислоя. Периферические мембранные белки (г) присоединяются к поверхности интегральных белков
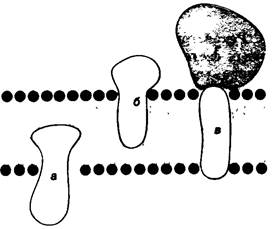
Для того чтобы определить, локализован ли данный белок во внутренней части мембраны, используют главным образом электронно-микроскопический метод замораживания—скалывания. Клетки или фрагменты мембраны быстро замораживают до температуры жидкого азота. Замороженную мембрану раскалывают далее толчком ножа микротома. Скол обычно проходит продольно посередине бислоя (рис. 10.19). В результате раскрывается значительная область внутренней части липидного бислоя. Далее эту обнажившуюся поверхность покрывают путем напыления слоем угля или платины, что дает реплику внутренней части бислоя. Для изучения наружной поверхности мембраны метод замораживания-скалывания используют в сочетании с методом глубокого травления. При этом сначала путем скола обнажают внутреннюю часть замороженной мембраны. Далее высушивают лед на прилежащей поверхности мембраны, это метод глубокого травления. Сочетание двух методов, называемое электронной микроскопией с применением замораживания—- травления, позволяет получить картину внутренней части мембраны и обеих ее поверхностей. Достоинство рассматриваемого подхода состоит в том, что он не требует фиксации и обезвоживания биологического материала.
Рис. 10.19. Электронно-микроскопический метод замораживания-скалывания. Плоскость скола проходит посередине мембраны бислоя
В исследованиях методом замораживания-травления было непосредственно доказано присутствие интегральных белков во многих биологических мембранах. Например, в мембране эритроцита содержатся глобулярные частицы высокой плотности диаметром около 75 А (рис. 10.20). Большое число глобулярных частиц имеется также внутри мембраны саркоплазматического ретикулума. В отличие от этого искусственный бислой из фосфатидилхолина имеет совершенно гладкую поверхность скола. Оказались большей частью гладкими и поверхности скола миелиновой мембраны, что и следовало ожидать от этой относительно инертной мембраны, функционирующей главным образом в качестве изолирующей поверхности.
Рис. 10.20. Электронная микрофотография плазматической мембраны эритроцита, полученная с применением метода замораживания - травления. Внутренняя часть мембраны, обнажившаяся при сколе, богата глобулярными частицами диаметром около 75 À. Эти частицы - интегральные белки мембраны

10.10. В мембране эритроцитов содержатся различные периферические и интегральные белки
В работах по изучению мембран эритроциты оказались наилучшим объектом исследований, поскольку они легко доступны и относительно просто устроены. Будучи лишены органелл, эритроциты имеют только одну мембрану-плазматическую. Путем осмотического лизиса можно получить тени эритроцитов, т. е. чистые плазматические мембраны, без цитоплазмы. На рис. 10.21 показаны результаты электрофоретического разделения белков такого мембранного препарата на полиакриламидном геле, содержащем ДСН. При окрашивании кумасси синим проявляется более десяти полос. Основные полосы пронумерованы и обозначаются как полосы 1, 2, 3, 4.1, 4.2, 5 и 6 (рис. 10.21). При окрашивании йодной кислотой-реактивом Шиффа (PAS-реакция)1 выявляется несколько белковых фракций, богатых углеводами. Эти полосы обозначаются соответственно PAS-1, PAS-2, PAS-3 и PAS-4.
1 В отечественной литературе вместо сокращения ИКШ нередко употребляется более благозвучное ШИК, однако оно не соответствует сути, поскольку обработка йодной кислотой предшествует обработке реактивом Шиффа. Поэтому мы будем пользоваться распространенным сокращением латинскими буквами PAS (periodic acid-Schiff reagent) - Прим, перев.
Рис. 10.21. Электрофоретическое разделение белков эритроцитарной мембраны на ДСН-полиакриламидном геле. Краситель кумасси синий
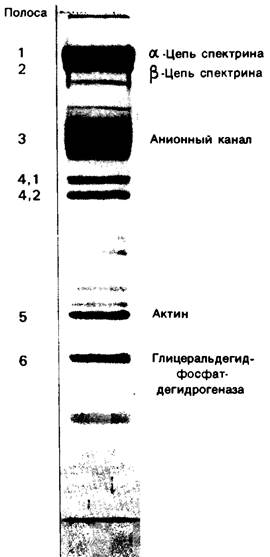
Где локализуются рассматриваемые белки в мембране эритроцита? Белки, соответствующие полосам 1, 2, 4.1, 4.2, 5 и 6, экстрагируются из мембран при повышении ионной силы раствора или изменений pH; следовательно, они расположены на периферии мембраны. Кроме того, на них не оказывает влияния инкубация интактных клеток или запаянных теней с различными протеолитическими ферментами. В то же время эти белки полностью расщепляются при обработке протеазами разорванных теней. Отсюда можно заключить, что эти периферические белки находятся на цитоплазматической стороне мембраны эритроцитов. Полоса 6-это фермент гликолиза глицеральдегид-3-фосфат — дегидрогеназа (разд. 12.5), полоса 5-актин, необходимый для мышечного сокращения и обеспечивающий клеточную подвижность (разд. 34.1). Полосы 1 и 2- спектрину цепи которого, соединяясь, образуют разветвленную волокнистую сеть. Вместе с другими белками спектрин, по-видимому, стабилизирует и регулирует форму мембраны эритроцитов, изменяющуюся при прохождении клеток через мелкие кровеносные сосуды (рис. 10.22). Кроме того, эритроциты подвергаются сильному механическому сдавливанию при проталкивании крови сердцем.
Рис. 10.22. При прохождении через мелкие кровеносные сосуды (капилляры) эритроциты подвергаются обратимой деформации

Что касается полос 3 и 7 и всех четырех полос, окрашивающихся РАS-реактивом, то их можно отделить от мембраны эритроцита только с помощью детергентов или органических растворителей. Следовательно, эти полосы представлены интегральными белками мембраны. Такой вывод подтверждается результатами электронно-микроскопического исследования: методом замораживания-скалывания (рис 10.20) было показано, что часть белков эритроцита погружена в глубь углеводородной области мембраны.