БИОХИМИЯ - Л. Страйер - 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ОТВЕТЫ НА ВОПРОСЫ И ЗАДАЧИ
Глава 2
1. а) Фенилизотиоцианат.
б) Дансилхлорид.
в) Мочевина; β-меркаптоэтанол для восстановления дисульфидов.
г) Химотрипсин.
д) CNBr.
е) Трипсин.
2. а) 3; б) 12; в) 4,28; г) 9,8; д) 2,4.
3. 0,01; 0,1; 1; 10; 100.
4. 477 А (318 остатков на цепь; 1,5 А на остаток).
5. Каждый аминокислотный остаток, за исключением С-концевого, при реакции с гидразином дает гидразид. С-концевой остаток можно идентифицировать по тому признаку, что он дает свободную аминокислоту.
6. а) Примерно + 1.
б) Два пептида.
7. Боковая цепь S-аминоэтилцистеина схожа с боковой цепью лизина; единственное различие заключается в том, что в молекуле S-аминоэтилцистеина вместо метиленовой группы стоит атом серы.
8. Нативная конформация инсулина-термодинамически не самая стабильная форма. Обсуждение этого вопроса см. в разд. 35.9.
Глава 3
1. а) 2,96 • 10-11 г.
б) 2,71 • 108 молекул.
в) Нет. Если бы гемоглобин находился в виде кубических кристаллов, то в одном эритроците умещалось бы 3,22-108 молекул. Следовательно, реальная плотность упаковки гемоглобина в эритроците составляет 84% от максимально возможной.
2. 2,65 г (или 4,75 • 10- 2 моль) Fe.
3. а) У человека 1,44 • 10 - 2 г (4,49 •10- 4 моль) O2 на 1 кг мышц. У кашалота 0,144 г (4,49 • 10-3 моль) O2 на 1 кг мышц.
б) 128.
4. а) Примерно + 36 при pH 2, + 4 при pH 7 и + 2 при pH 9.
б) Примерно 10. Однако имеет место взаимодействие титрующихся групп, поэтому действительная изоэлектрическая точка равна 8,2.
5. а) Три пептида, состоящие из остатков от 1 до 55, от 56 до 131 и от 132 до 153. б) Короткие α-спирали мало стабильны в водном растворе. В миоглобине они стабилизированы третичными взаимодействиями.
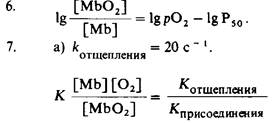
б) Средняя продолжительность равна 0,05 с (величина, обратная котщепления).
8. Раствор миоглобина 1 мг/мл (масса миоглобина = 17,8 кДа соответствует концентрации 5,62 • 10-5М. Светопоглощение этого раствора при длине оптического пути 1 см составляет 0,84, что соответствует отношению /0//, равному 6,96. Следовательно, через раствор проходит 14,4% падающего света.
Глава 4
1. а) Увеличит.
б) Снизит.
в) Снизит.
г) Снизит сродство к кислороду.
2. а и б) Свяжется меньше Н+.
3. Инозитолгексафосфат.
4. a) ∆Y = 0,977 - 0,323 = 0,654, б) AY = 0,793 - 0,434 = 0,359.
5. а) рК снизится.
б и в) рK увеличится.
6. Дополнительная метильная группа препятствует перемещению атома железа в плоскость порфирина при оксигенировании. Это модельное соединение имитирует Т-состояние гемоглобина.
7. а) Да. Кав=Ква(Кв/Ка) = 2.10 • 5М.
б) Наличие А повышает связывание В и аналогично присутствие В повышает связывание А.
8. Оксид углерода, присоединившись к одному гему, изменяет сродство к кислороду других гемов в той же молекуле гемоглобина. В частности, СО повышает сродство гемоглобина к кислороду и тем самым снижает количество 02, высвобождаемое в тканях. Оксид углерода оказывает стабилизирующее действие на характеристики четвертичной структуры оксигемоглобина. Другими словами, СО имитирует О2 в качестве аллостерического эффектора.
9. а) Транспорт максимален при К=10-5М. В общем случае транспорт достигает максимума при![]()
б) Максимальный перенос кислорода при Р50 = = 44,7 торр, что значительно выше, чем 26 торр величина, характерная для физиологических условий. Следует подчеркнуть, что в этом расчете не учитываются кооперативность связывания и эффект Бора.
Глава 5
1. а) Лизин или аргинин в положении 6.
б) При pH 8 этот гемоглобин будет двигаться к аноду медленнее двух других гемоглобинов, поскольку у него наименьший общий отрицательный заряд.
2. а) НbС; б) НbD; в) НbJ; г) НbN.
3. Мутации гена а влияют на все три гемоглобина, поскольку эти гемоглобины имеют соответственно следующие субъединичные структуры: α2β2, α2δ2 и α2γ2. Мутации генов β, б и γскажутся только на одном из типов гемоглобина.
4. Реакция
2(α2ββS) ⇄ α2β2 + α2βS2
протекает быстро по сравнению со временем проведения электрофореза. Разделение α2α2 и α2αS2 в электрическом поле сдвигает равновесие реакции вправо.
5. Дезокси-НbА содержит комплементарный участок и поэтому может присоединиться к волокну дезокси НbS. Дальнейшее удлинение волокна будет уже невозможным, так как в концевой молекуле дезокси-НbА нет липкого участка.
6. Свойственная дезоксигемоглобину А водородная связь между аспартатом и тирозином в участке α1α2-контакта отсутствует в гемоглобине Кеmрsеу (с. 100). Следовательно, дезокси- форма этого мутантного гемоглобина должна легче диссоциировать на димеры, чем нормальный гемоглобин. С другой стороны, оксигенированные формы обоих гемоглобинов диссоциируют примерно одинаково, поскольку указанная водородная связь не участвует в стабилизации ни того, ни другого гемоглобина.
Глава 6
1. а) 31,1 • 10-6 моль.
б) 5 • 10- 8 моль.
в) 622 с-1.
2. а) Да. КM =5,2 • 10-6 М.
б) Vмакс =6,84 • 10-10 моль.
в) 337 с-1.
3. а) В отсутствие ингибитора Vмакс= 47,6 мкмоль/мин и = 1,1 • 10- 5 М. В присутствии ингибитора V макс не меняется, а кажущаяся КМ =3,1 • 10-5 М.
б) Конкурентное ингибирование.
в) 1,1 •10-3 М.
Г) f/ЕS = 0,243 и fЕI = 0,488.
д) В отсутствие ингибитора fES = 0,73, а в присутствии 2 • 10- 3 М ингибитора fES = 0,49. Соотношение этих величин, равное 1,49, эквивалентно соотношению скоростей реакции в тех же условиях.
4. а) Vмакс— 9,5 мкмоль/мин. КМ. = 1,1 • 10 - 5 М, так же, как и в отсутствие ингибитора.
б) Неконкурентное.
в) 2,5 • 10-5 М.
г) 0,73 как в присутствии, так и в отсутствие ингибитора.
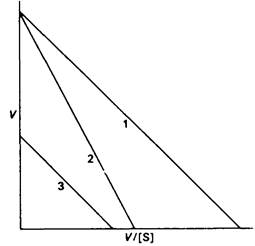
5. а) V=Vмакс -(V/S) KM.
б) Наклон = — KM; пересечение с осью у равно Vмакс; пересечение с осью х соответствует Vмакс/KM.
в) 1-без ингибитора,
2-конкурентный ингибитор,
3-неконкурентный ингибитор.
6. Связывание конкурентного ингибитора в одном активном центре аллостерического фермента может привести к повышению сродства к субстрату другого участка в той же молекуле фермента. В соответствии с моделью согласованного механизма такой конкурентный ингибитор способствует переходу Т → R.
7. Потенциально при образовании водородных связей при pH 7 донорами могут служить боковые цени следующих аминокислотных остатков: аргинина, аспарагина, глутамина, гистидина, лизина, серина, треонина, триптофана и тирозина.
8. Скорости использования А и В задаются уравнениями
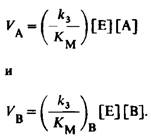
Отсюда соотношение скоростей равно
![]()
Следовательно, фермент выбирает тот или иной из конкурирующих субстратов в зависимости от значения k3!!!!KM, а не только КM.
Глава 7
1. Быстрее всех гидролизуется (б), медленнее всех - (а),
2. а) В—С; б) А—В и Е F; в) А—В -С (один остаток сахара не взаимодействует с ферментом, вследствие чего участок D как энергетически невыгодный остается незанятым.
3. 18О окажется в гидроксильной группе при С-4 в ди-NAG (остатки Е—F).
4. Этот аналог, будучи лишен громоздкою заместителя при С-5, может, по-видимому, связываться в участке D, не претерпевая деформации. Отсюда следует, что связывание остатка D данного аналога в отличие от связывания остатка D, принадлежащего тетра-NAG, не требует притока свободной энергии.
5. a) В оксигемоглобине Fe связан с пятью атомами азога и одним атомом кислорода. В карбок- сипептидазе A Zn связан с двумя атомами азота и двумя атомами кислорода.
б) В оксимиоглобине один из атомов азота, связанных с Fe, принадлежит проксимальному остатку гистидина, а остальные четыре-гему. Атом кислорода, связанный с Fe, происходит из O2. В карбоксипептидазе А два атома азота, координационно связанные с Zn, принадлежав остаткам гистидина. Один из связанных с Zn атомов кислорода принадлежит глутаматной боковой цепи, второй - молекуле воды.
в) Аспаргат, цистеин и метионин.
6. Вода, меченная 18О, образуется в случае, если карбоксилептидаза А катализирует синтез пептидной связи между N-бензоилглицином и L-фенилаланином. В присутствии L-jî-фенил молочной кислоты 18О не включается в Н2О, поскольку в этом соединении нет аминогрупп и потому синтез пептидной связи не идет.
Глава 8
1. a) Карбоксипептидаза A.
б) Лизоцим и карбоксипептидаза А.
в) Химотрипсин.
г) Карбоксипептидаза А и химотрипсин.
2. а) Да.
б) В химотрипсине - гистидин-57, в лизоциме — глутамат-85, в карбоксипептидазе А - тирозин-248.
3. В химотрипсине-серин-195, в карбоксипептидазе А - глутамат-270 (или гидроксильный ион).
4. Точное расположение участвующих в катализе остатков и субстратов, геометрическое растяжение (деформация субстрата), перемещение электронов и десольватация субстрата.
5. а) Тозил-Ь-лизилхлорометилкетон (ТЛХК).
б) Сначала определите, способны ли субстраты предотвратить инактивацию трипсина под действием ТЛХК. Затем проверьте, способен ли D-изомер ТЛХК инактивировав трипсин.
в) Тромбин.
6. а) Серин.
б) Полуальдегид между альдегидной группой ингибитора и гидроксильной группой серина в активном центре.
7. Атом бора присоединяется к атому кислорода, принадлежащему серину в активном центре, Геометрия образующегося тетраэдрического промежуточною продукта аналогична переходному состоянию,
8. Активированный фактор X остается связанным с мембранами тромбоцитов, что ускоряет активацию им протромбина.
9. Антитромбин III, по-видимому, аналог переходного состояния, поэтому для его взаимодействия с тромбином требуется полностью сформированный активный центр,
10 Аминокислотные остатки а и d расположены внутри α-спирализованной суперспирали, вблизи ее оси. Гидрофобные взаимодействия между боковыми цепями этих остатков стабилизируют суперспираль.
Глава 9
1. а) Каждым третьим остатком в каждой из цепей коллагена должен быть глицин, так как для более крупного по размеру аминокислотною остатка просто нет свободного пространства,
б) Температура плавления поли(Glу-Рго-Glу) ниже, чем температура плавления поли(Glу-Рго-Рго).
в) Нет. Глицин не занимает каждого третьего положения.
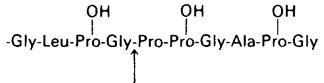
2. а) и б)
Стрелкой показана расщепляемая пептидная связь.
3. а) Дисульфиды.
б) Нет.
в) Пептидные связи между специфическими глутаминовыми и лизиновыми боковыми цепями.
г) Альдольная поперечная связь, гистидин-альдольная поперечная связь и лизилнорлейцин.
д) Альдольная поперечная связь, лизилнорлейцин и десмозин.
4. Декарбоксилирование а-оксоглутарата-это половина физиологической реакции. По-видимому, сначала а-оксоглутарат подвергается атаке со стороны кислорода и образуется перокси-кис- лота, которая далее вступает в реакцию с субстратом, содержащим пролин.
Глава 10
1. 2,86 • 106 молекул.
2. Циклопропановое кольцо препятствует упорядоченной упаковке углеводородных цепей и тем самым повышает текучесть мембран.
3. 2 • 10-7 см; 6,32 • 10-6 см и 2 • 10-4 см.
4. Радиус этой молекулы 3,08 • 10-7 см и коэффициент диффузии 7,37 • 10-9 см2/с. Среднее расстояние за 1 мкс составит 1,72 • 10-7 см; за 1 мс-5,42 • 10-6 см и за 1с- 1,72 • 10-4 см.
5. Первоначальное снижение амплитуды парамагнитного резонансного спектра обусловлено восстановлением спин-меченных фосфатидилхолинов в наружном слое бислоя. Аскорбат в условиях опыта не проходит через мембрану и потому не восстанавливает фосфолипиды внутреннего слоя. Медленное затухание остаточного спектра объясняется восстановлением фосфолипидов, поперечно диффундировавших в наружный слой.