БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 35. ДЕЙСТВИЕ ГОРМОНОВ
35.11. Рецепторы инсулина локализованы в плазматической мембране клеток-мишеней
Инсулин прочно связывается со специфическими рецепторами на плазматической мембране клеток-мишеней. Это выявляется в опытах с использованием радиоактивного инсулина, содержащего ковалентно связанный 125I. Константа диссоциации инсулин-рецепторного комплекса составляет около 10-10 М. Необходимость в столь прочном связывании объясняется низкой концентрацией инсулина в крови (порядка 10-10 М). Константа скорости образования комплекса очень велика (около 107 М-1 • с-1) и приближается к величине, характеризующей реакции, скорость которых регулируется только скоростью диффузии. Клетка жировой ткани содержит всего лишь 1 • 104 рецепторов инсулина, что соответствует плотности один рецептор на квадратный микрометр плазматической мембраны. Иными словами, один рецептор инсулина приходится на 1 • 106 фосфолипидов мембраны.
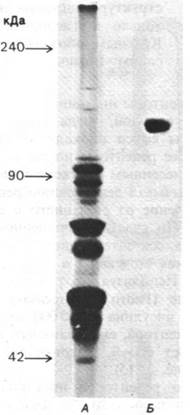
Параметры связывания инсулина с солюбилизированным рецептором и с рецептором в интактной плазматической мембране одинаковы. Солюбилизированные рецепторы были очищены методом аффинной хроматографии, т. е. методом, основанным на использовании специфических связывающих свойств рецептора. Для очистки препарат солюбилизированных мембран пропускали через колонку агарозы с ковалентно присоединенным инсулином; рецепторы инсулина прочно связывались с колонкой, тогда как остальные компоненты смеси проходили сквозь колонку. Далее рецепторы инсулина элюировали подкисленным раствором мочевины, который вызывал денатурацию рецепторов и их отделение от связанного с агарозой инсулина. По счастью, очищенные рецепторы удавалось затем ренатурировать путем удаления мочевины и повышения рН раствора. Используя этот метод, Педро Кватрсказас (Pedro Cuatrecasas) очистил рецепторы инсулина в 250000 раз. Субъединица рецептора, связывающего инсулин, представляет собой гликопротеин массой 135 кДа (рис. 35.15).
Рис. 35.15. Гель-электрофорез экстракта плазматических мембран клеток печени (А) и очищенного рецептора инсулина (Б). Электрофорез проводился в денатурирующих условиях
На долю рецепторов инсулина приходится всего лишь 4 • 10-3% общего количества мембранных белков в гомогенате печени. Следовательно, чтобы получить в чистом виде 1 мг белка-рецептора, необходимо подвергнуть обработке количество гомогената, эквивалентное 500 г белка, а для этого нужно взять печень от 200 крыс. Этот расчет показывает, что выделение рецепторов в количестве, достаточном для определения последовательности аминокислот, рентгеноструктурного анализа
и опытов по реконструированию, представляет собой трудоемкую, но все же выполнимую задачу.
По всей вероятности, взаимодействие инсулина с рецепторами на плазматической мембране запускает многие быстро развивающиеся эффекты инсулина, например, активацию транспорта аминокислот и глюкозы через мембрану. К числу быстро развивающихся эффектов инсулина относится также фосфорилирование белка, принадлежащего рибосомной 40S-субчастице. Все эти эффекты гормона не связаны с изменением содержания сАМР. Какие вещества опосредуют действие инсулина в клетке, пока еще не установлено.
Диабет - название указывает на повышенное мочеиспускание. Аретей, каппадокийский врач второго столетия н.э., писал: «Эпитет «диабет» относится к состоянию, похожему на прохождение воды по сифону». Он с тонкой наблюдательностью охарактеризовал диабет как «растворение плоти и конечностей и превращение их в мочу».
Сахарный - (по латыни mellitus, т.е. «подслащенный медом») указывает на присутствие сахара в моче больных диабетом.
35.12. Недостаточность инсулина вызывает диабет
Сахарный диабет - это сложное заболевание, которым страдают несколько сот миллионов людей. Диабет характеризуется повышенным уровнем глюкозы в крови и в моче. Выделение глюкозы с мочой наступает в условиях, когда содержание глюкозы в крови превышает способность почечных канальцев к реабсорбции. Вместе с глюкозой выделяется много воды, так что нелеченый больной в острой стадии заболевания испытывает голод и жажду. Потеря глюкозы приводит к израсходованию запасов углеводов, а затем и к расщеплению жиров и белков. В результате мобилизации жиров образуется большое количество ацетил-СоА. Если ацетил-СоА не может полностью использоваться в цикле трикарбоновых кислот из-за недостаточного количества оксалоацетата, то образуются кетоновые тела (ацетоацетат, ацетон и гидроксимасляная кислота). Вспомним, что в организме животных синтеза оксалоацетата из ацетил-СоА не происходит; у животных оксалоацетат образуется из глюкозы и некоторых аминокислот (разд. 23.4). Выделение кетоновых тел нарушает кислотно-щелочное равновесие и усиливает обезвоживание организма. В итоге в острой стадии диабета у нелеченого больного может развиваться кома и наступить смерть.
Сахарный диабет обусловлен недостаточностью инсулина. Причины же недостаточности инсулина в большинстве случаев неизвестны. Диабет удается воспроизвести
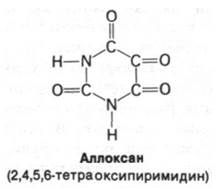
у экспериментальных животных путем хирургического удаления значительной части поджелудочной железы либо путем химического разрушения β-клеток. Эти продуцирующие инсулин клетки избирательно разрушаются при введении аллоксана. Диабет можно также вызвать введением антител против инсулина. Еще одно доказательство той важной роли, которую играет инсулиновая недостаточность в развитии диабета, состоит в том, что введение инсулина быстро снимает острые симптомы диабета.
Почему у больного диабетом количество инсулина оказывается ниже потребностей в нем тканей? В настоящее время установлено, что в основе клинического состояния, называемого сахарным диабетом, может лежать множество различных молекулярных дефектов. Рассмотрим некоторые из причин диабета.
1. Нарушение превращения проинсулина в инсулин. В результате мутаций, затрагивающих остатки аминокислот в участке соединения А-цепи (или В-цепи) с С-пептидом в проинсулине, может нарушиться его превращение в инсулин. У таких больных в плазме крови обнаруживается высокий уровень содержания проинсулина (не обладающего гормональной активностью).
2. Нарушение молекулярной структуры инсулина. Еще один тип мутаций приводит к замене аминокислотного остатка в критически важном участке молекулы инсулина. Так, если произошла замена фенилаланина на лейцин вблизи карбоксильного конца В-цепи, то гормональная активность такого инсулина оказывается сниженной в 10 раз. Любопытно, что этот участок молекулы инсулина сохраняется неизменным в эволюции, начиная с примитивных миксин и до человека.
3. Дефект рецепторов инсулина. У некоторых больных секретируется нормальный инсулин, но нарушается его связывание с клетками-мишенями. Следовательно,
в этом случае имеет место дефект рецепторов инсулина в плазматических мембранах.
4. Нарушение сопряжения рецепторов инсулина. Бывают случаи, когда у больных секретируется нормальный инсулин, клетки-мишени содержат обычное число рецепторов инсулина и параметры связывания гормона рецептором также соответствуют норме. По-видимому, у этих больных нарушения локализованы внутри клетки. Возможно, в частности, что отсутствует сопряжение между инсулин-рецепторным комплексом и следующим компонентом в цепи передачи гормонального сигнала.
35.13. Эндорфины - пептиды мозга, действующие подобно опиатам
На протяжении веков опиаты, в частности морфин, использовались как болеутоляющие средства. В 1680 г. Томас Сиденхем (Thomas Sydenham) писал: «Среди всех лекарств, которые всевышний даровал человеку, дабы облегчить его страдания, нет более универсального и более действенного, чем опий». Но почему в мозгу позвоночных содержатся рецепторы к алкалоидам из семян мака? Нейрофармакологи предположили, что опиатные рецепторы предназначены не для взаимодействия с растительными алкалоидами, а для восприятия эндогенных регуляторов ощущения боли. Согласно этой точке зрения, морфин оказывает фармакологический эффект только потому, что он имитирует вещества, существующие в организме животного. Вопрос этот был окончательно разрешен в 1975 г., когда Джон Хьюз (John Hughes) выделил из мозга свиньи два пептида с опиатоподобной активностью. Эти сходные между собой пентапептиды, названные метионин-энкефалином и лейцин- энкефалином, присутствуют в большом количестве в некоторых нервных окончаниях. По-видимому, они участвуют в интеграции сенсорной информации, имеющей отношение к боли.
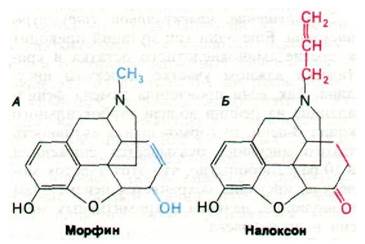
Спустя год Роджер Гилемин (Roger Guillemin) выделил из промежуточной доли гипофиза более длинные пептиды — эндорфины. Эндорфины обладают почти такой же способностью снимать ощущение боли, как морфин (при той же концентрации). Введение эндорфинов в желудочки мозга лабораторным животным оказывает примечательное действие. Так, β-эндорфин на несколько часов индуцирует глубокую анальгезию всего тела, причем в этот период понижается температура тела. Более того, у животных возникает ступор, и они лежат распластавшись. Спустя несколько часов действие эндорфинов исчезает, и животные вновь ведут себя нормально. Выяснился также удивительный факт, что действие эндорфинов исчезает через несколько секунд после введения налоксона (рис. 35.17), известного антагониста морфина. Судя по поведенческим реакциям, индуцированным эндорфинами, эти пептиды в нормальных условиях участвуют в регуляции эмоциональных ответов. Многие методы, необходимые для проверки этой гипотезы, уже разработаны. Так, для определения крайне малых количеств пептидов, например, эндорфинов, используется радиоиммунологический анализ, который сочетает чувствительность радиоизотопных методов со специфичностью иммунной реакции. Здесь мы сталкиваемся
с зарождением новой и многообещающей области нейробиологии и нейропсихиатрии.
Рис. 35.16. Последовательности аминокислот метионин-энкефалина (A), лейцин-энкефалина (Б) и β-эндорфина (В). Синим цветом показана общая для них тетрапептидная последовательность

Рис. 35.17. Структура морфина - опиата (А) и налоксона - антагониста морфина (Б)