БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 37. ВОЗБУДИМЫЕ МЕМБРАНЫ И СЕНСОРНЫЕ СИСТЕМЫ
37.8. Ингибиторы ацетилхолинэстеразы используются как лекарственные средства и как яды
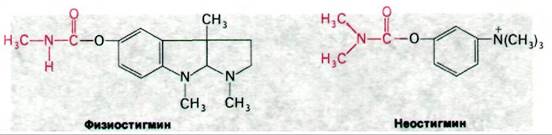
Терапевтические и токсические свойства ингибиторов ацетилхолинэстеразы нашли широкое практическое применение. Алкалоид из калабарских бобов физостигмин (называемый также эзерин) когда-то использовался при испытании ядом в судилище над колдунами и ведьмами. Физостигмин и родственные ему ингибиторы, например, неостигмин, являются карбамоильными эфирами (рис. 37.13). Они ингибируют ацетилхолинэстеразу путем образования ковалентного промежуточного соединения, которое очень медленно гидролизуется. Неостигмин связывается с ацетилхолинэстеразой таким образом, что его положительно заряженная триметиламмониевая группа встает в анионном участке фермента, а карбамоильная группа оказывается рядом с реакционноспособным остатком серина в участке этерификации. Далее происходит карбамоилирование фермента и высвобождается образующийся спирт.
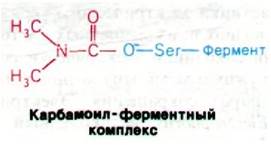
Рис. 37.13. Физостигмин и неостигмин ингибируют ацетилхолинэстеразу путем карбамоилирования серина в активном центре фермента
Последующий гидролиз карбамоильного производного фермента в отличие от гидролиза ацетил—фермента происходит с очень низкой скоростью. В итоге активный центр ацетилхолинэстеразы оказывается прочно заблокированным. Неостигмин используется для лечения глаукомы - болезни глаз, характеризующейся повышенным внутриглазным давлением. Механизм терапевтического эффекта состоит в том, что неостигмин ингибирует ацетилхолинэстеразу и тем самым усиливает действие ацетилхолина.
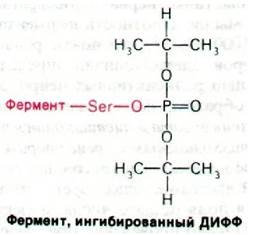
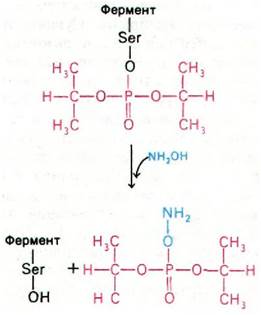
Еще более мощные ингибиторы ацетилхолинэстеразы - органические фторфосфаты, в частности диизопропилфторфосфат (ДИФФ). Эти соединения реагируют с ацетилхолинэстеразой, образуя высокостабильные ковалентные фосфорил-ферментные комплексы (рис. 37.14). Как и при взаимодействии с сериновыми протеиназами, фосфорильная группа ДИФФ связывается с серином в активном центре фермента.
Рис. 37.14. Ингибированная диизопропилфторфосфатом ацетилхолинэстераза
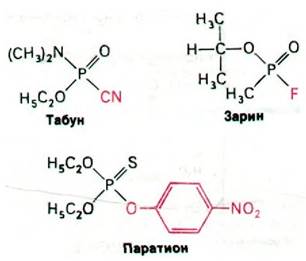
Множество различных органических фторфосфатов было синтезировано для использования в качестве инсектицидов в сельском хозяйстве, а также в качестве отравляющих веществ - нервнопаралитических ядов в химической войне (рис. 37.15). Эти соединения могут вызвать смерть путем остановки дыхания. Наиболее токсичны из них - табун и зарин. Паратион - инсектицид, нашедший широкое применение в сельском хозяйстве.
Рис. 37.15. Структурные формулы нескольких органических фосфатов - ингибиторов ацетилхолинэстеразы
Путем использования радиоактивного ДИФФ в качестве метки было определено число молекул ацетилхолинэстеразы в концевой пластинке нерва в диафрагмальной мышце мыши. Плотность фермента составила 12000 мкм-2, что почти равно числу рецепторов ацетилхолина, определенному с помощью радиоактивных нейротоксинов. Таким образом, постсинаптическая мембрана очень богата и ацетилхолинэстеразой, и ацетилхолиновыми рецепторами. При передаче нервных импульсов, поступающих с малой частотой, используется только небольшая доля общего числа молекул фермента. Однако проведение при высокой частоте импульсации требует участие множества молекул ацетилхолинэстеразы.
37.9. Разработка антидота для лечения отравлений органическими фосфатами
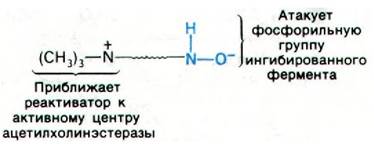
Ацетилхолинэстеразу, ингибированную органическими фторфосфатами типа ДИФФ, можно реактивировать производными гидроксиламина (NH2OH). При разработке антидота исходили из обнаруженного Ирвином Уилсоном (Irvin Wilson) факта, что гидроксиламин высвобождает фосфорильную группу, присоединенную к сериновому остатку ингибированного фермента, и тем самым реактивирует его (рис. 37.16). Задача состояла в том, чтобы приспособить эту реакцию для клинического использования. Однако гидроксиламин нельзя использовать in vivo, поскольку в тех высоких концентрациях, которые необходимы для реактивации ацетилхолинэстеразы, ингибированной ДИФФ, он токсичен. Выбранный Уилсоном подход состоял в том, чтобы найти соединение, обладающее реакционной способностью гидроксиламина, но со специфичностью и очень высоким сродством к ацетилхолинэстеразе. Относительно фермента было известно, что на нем есть анионный участок для связывания положительно заряженного остатка холина в ацетилхолине, и потому представлялось целесообразным синтезировать производное гидроксиламина, содержащее четвертичную аммониевую группу. Возникал, однако, вопрос, где должен стоять заместитель: при атоме кислорода или азота гидроксиламина? Было обнаружено, что О-метилгидроксиламин лишен способности реактивировать фермент, тогда как N-метилгидрок- силамин обладал такой активностью. Гидроксильная группа реактиватора не может быть замещена, поскольку именно анионная форма соединения атакует атом фосфора в ингибированном ферменте.
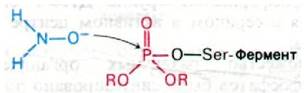
Рис. 37.16. Реактивация гидроксиламином ацетилхолинэстеразы, ингибированной диизопропилфторфосфатом
Следующий и основной этап состоял в том, чтобы поместить четвертичную аммониевую группу на необходимом расстоянии от нуклеофильного атома кислорода. Более того, требовалось, чтобы по своей ориентации эти группы были комплементарны анионному участку и атому фосфора в ингибированном ферменте.
В качестве реактиваторов были испробованы многочисленные соединения, содержащие четвертичную аммониевую группу и гидроксиламинную функцию. Наиболее эф фективным среди них оказался 2-пиридинальдоксимметиодид (ПАМ). Это соединение обладает устойчивой геометрией благодаря двойной связи в оксиме, которая способствует удержанию атома кислорода в плоскости кольца.
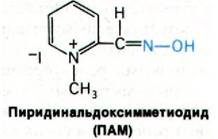
ПАМ реактивирует ингибированную ДИФФ ацетилхолинэстеразу в принципе по тому же механизму, что и гидроксиламин. Однако по эффективности 10-6 М ПАМ соответствует 1 М гидроксиламина. Такое повышение эффективности в 1000000 раз позволяет использовать ПАМ для лечения отравлений органическими фосфатами. Удивительная эффективность ПАМ обусловлена оптимальным расположением четвертичной аммониевой группы по отношению к нуклеофильному атому кислорода. Разработка этого препарата явилась вехой в развитии рационального подхода к синтезу лекарственных препаратов.
37.10. Ингибиторы ацетилхолинового рецептора
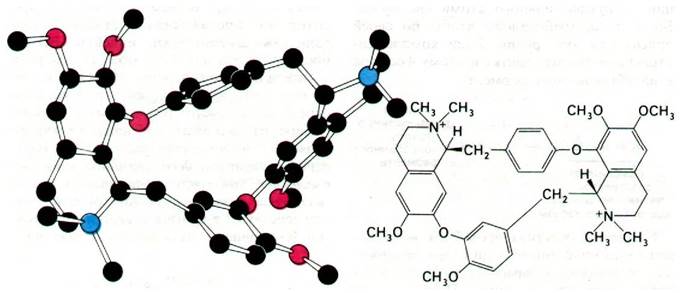
Блокаторами нервно-мышечного проведения служат также соединения, непосредственно воздействующие на ацетилхоли- новый рецептор. К ним относится кураре, который на протяжении столетий использовали южноамериканские индейцы. Вскоре после возвращения Колумба из Америки д'Ангера в своем сочинении «De Orbo novo» отмечал, что «местные жители отравляли стрелы соком смертельно-ядовитой травы». Одним из активных компонентов кураре является d-тубокурарин (рис. 37.17). Тубокурарин ингибирует деполяризацию концевых пластинок, конкурируя с ацетилхолином за связывание с рецептором. Аналогичным путем действуют α-бунгаротоксин и кобратоксин. В отличие от этого вещества типа декаметония соединяются с рецептором ацетилхолина, вызывая устойчивую деполяризацию концевой пластинки.
Рис. 37.17. Формула и модель α-тубокурарина
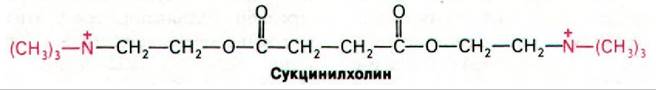
В хирургии в качестве препарата, вызывающего расслабление мышц, используется аналог ацетилхолина - сукцинилхолин.
Сукцинилхолин крайне медленно гидролизуется ацетилхолинэстеразой в постсинаптической мембране. Вследствие этого он вызывает устойчивую деполяризацию концевой пластинки. В то же время сукци- нилхолин гидролизуется под действием менее специфических холинэстераз в плазме и в печени; эти ферменты назвали плазменными ацетилхолинэстеразами или псевдохолинэстеразами для того, чтобы отличить их от ацетилхолинэстеразы постсинаптической мембраны. Сукцинилхолин удобен тем, что при его использовании нервно-мышечное проведение восстанавливается вскоре после того, как перестают вводить этот препарат. Однако в отдельных случаях мышечное расслабление и паралич дыхательных мышц сохраняются на протяжении многих часов. Дело в том, что в таких случаях гидролиз сукцинилхолина у больных идет крайне медленно из-за сильно сниженного сродства плазменной холинэстеразы к сукцинилхолину. Повышенная чувствительность к сукцинилхолину [так же, как и памахину (разд. 15.11)] - пример генетически детермированной лекарственной идиосинкразии.
Если кроликов иммунизировать очищенными ацетилхолиновыми рецепторами, то спустя несколько недель после иммунизации у них наблюдается мышечная слабость
и быстрая утомляемость. Объясняется это тем, что в результате иммунизации у них вырабатываются антитела, реагирующие с ацетилхолиновыми рецепторами их собственных нервно-мышечных соединений. В итоге число функционально активных ацетилхолиновых рецепторов уменьшается, что приводит к ухудшению нейромышечной передачи. Развивающееся у этих кроликов состояние очень напоминает тяжелую болезнь человека - миастению (myasthenia gravis), и, действительно, в сыворотке больных миастенией содержатся антитела, направленные против собственных рецепторов ацетилхолина. Другими словами, myasthenia gravis является аутоиммунным заболеванием, т. е. таким заболеванием, при котором организм оказывается мишенью действия собственной иммунной системы.