БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 27. СИНТЕЗ БЕЛКА
27.15. В результате образования инициирующего 708-комплекса формил- метиониновая тРНК связывается с Р-участком
Синтез белка начинается с ассоциации мРНК, рибосомной 30S-субчастицы и формилметиониновой тРНК. Они образуют 30S-комплекс инициации (рис. 27.20). Для образования этого комплекса необходимы GTP и три белковых фактора, называющихся IF-1, IF-2 и IF-3. Один из этих факторов инициации - IF-3 - участвует в связывании мРНК с 30S-субчастицей. Кроме того, IF-3 препятствует ассоциации 50S- и 30S-субчастиц с образованием непродуктивного 70S- комплекса без мРНК, a IF-1 и IF-2 способствуют связыванию инициаторной тРНК с комплексом мРНК и 30S-субчастицы.
Рис. 27.20. Стадия инициации синтеза белка: образование 30S-комплекса инициации и затем 70S-комплекса инициации
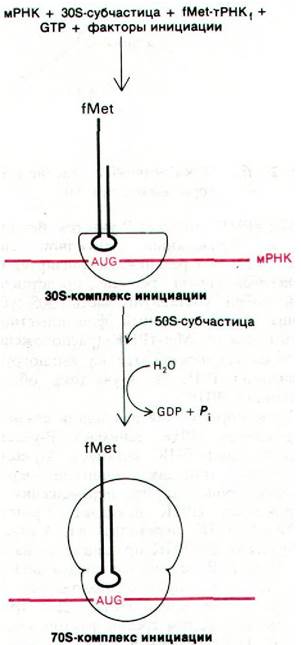
Затем 50S-субчастица присоединяется к инициаторному 30S-комплексу, образуя инициаторный 70S-комплекс. На этом этапе происходит гидролиз связанного GTP. 70S- инициаторный комплекс (рис. 27.20) готов к стадии элонгации белкового синтеза. Молекула fMet-тРНК1 занимает Р-участок (пептидильный участок) рибосомы. Второй участок на рибосоме для связывания молекулы тРНК-А-участок (аминоацильный) - еще пуст. Существование раздельных участков Р и А было показано при изучении пуромицина - антибиотика, о котором говорится ниже (разд. 27.21). Сейчас важно отметить, что fMet-тРНК1 располагается таким образом, что антикодон спаривается с инициирующим кодоном AUG (или GUG) в мРНК. Таким образом, рамка считывания устанавливается специфическим взаимодействием рибосомы и fMet-тРНК, с мРНК. Напомним, что в этом взаимодействии участвует богатый пурином участок, расположенный со стороны 5'-конца от инициирующего кодона. Он спаривается с З'-концом 16S-PHK, входящей в состав 30S-субчастицы. Выяснение этого сложного способа, которым достигается правильная ориентация инициаторной тРНК, породило любопытную проблему. Каким же образом в опытах по расшифровке генетического кода (разд. 26.3) могли транслироваться poly(U) и другие синтетические полипептиды без сигналов начала трансляции? Ответ заключается в том, что, к счастью, в этих экспериментах происходила неспецифическая трансляция благодаря тому, что концентрация Mg2+ в реакционной смеси была выше, чем это имеет место in vivo.
27.16. Фактор элонгации Тu доставляет аминоацил-тРНК в А-участок рибосомы
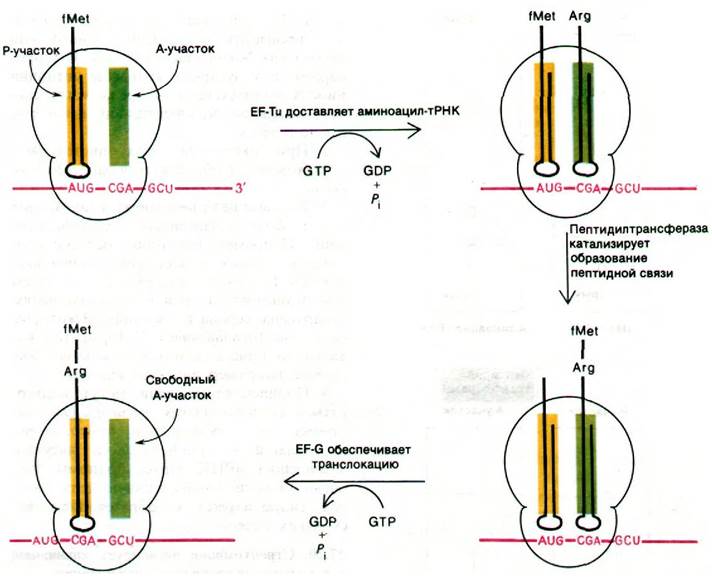
Цикл элонгации белкового синтеза включает три этапа: 1) связывание аминоацил- тРНК (узнавание кодона); 2) образование пептидной связи; 3) транслокация. Цикл начинается с введения аминоацил-тРНК в пустой А-участок рибосомы. Выбор определенной разновидности тРНК зависит от того, какой кодон мРНК находится в А-участке. Комплементарная аминоацил- тРНК доставляется в А-участок белком, который называется фактором элонгации EF-Tu. Когда аминоацил-тРНК занимает правильное положение на рибосоме, происходит гидролиз GTP, связанного с EF-Tu. GDP остается прочно связанным с EF-Tu до тех пор, пока он не вытесняется другим фактором элонгации, а именно EF-Ts. Образовавшийся комплекс Tu с Ts распадается при связывании GTP с Тu; новый комплекс Tu-GTP готов для следующего раунда элонгации. Эта ассоциация и диссоциация белков (рис. 27.21) ускоряется и приобретает характер повторяющегося цикла за счет энергии гидролиза GTP.
Рис. 27.21. Цикл реакций с участием фактора элонгации Тu
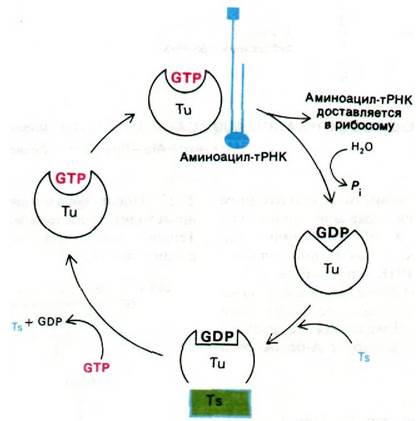
Важно отметить, что EF-Tu не взаимодействует с fMet-mPHK1. Поэтому инициаторная тРНК не попадает в А-участок. В то же время Меt-тРНК связывается с EF-Tu, подобно всем другим аминоацил- тРНК. Этим и объясняется тот факт, что внутренние кодоны AUG не считываются инициаторной тРНК.
27.17. После образования пептидной связи происходит транслокация
Теперь у нас имеется комплекс, в котором аминоацил-тРНК занимает А-участок, а fMet-тРНК занимает Р-участок. Все готово к образованию пептидной связи (рис. 27.22). Эту реакцию катализирует пептидилтрансфераза - фермент, представляющий собой составную часть 50S-субчастицы. Активированный формилметиони- новый остаток fMet-TPHK1 (расположенной в Р-участке) переносится на аминогруппу аминоацил-тРНК (в А-участок), образуя дипетидил-тРНК.
Рис. 27.22. Образование пептидной связи
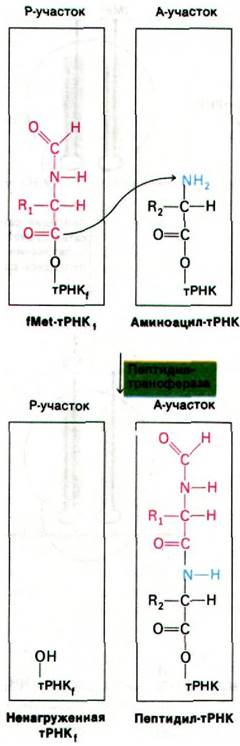
После образования пептидной связи ненагруженная тРНК занимает Р-участок, а дипептидил-тРНК занимает А-участок. Следующий этап цикла элонгации - транслокация. Происходят три перемещения: ненагруженная тРНК покидает Р-участок, пептидил-тРНК переходит из А-участка в Р-участок и мРНК продвигается на три нуклеотида. В результате следующий кодон занимает нужное положение для считывания очередной мРНК. Для транслокации необходим третий фактор элонгации - EF-G (называемый также транслоказой). Вовремя транслокации происходит гидролиз GTP, связанного с EF-G. Гидролиз GTP обусловливает отделение EF-G от рибосомы. Следовательно, GTP может действовать каталитически. Транслокация - еще один пример направленного движения, энергию для которого обеспечивает гидролиз нуклеозидтрифосфата. После транслокации А-участок освобождается и подготавливается к связыванию аминоацил-тРНК, чтобы начать новый цикл элонгации (рис. 27.23).
Рис. 27.23. Стадия элонгации синтеза белка: связывание аминоацил- тРНК, образование пептидной связи и транслокация