БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
Часть IV ИНФОРМАЦИЯ
ГЛАВА 31. ПЕРЕСТРОЙКИ ГЕНОВ: РЕКОМБИНАЦИЯ, ТРАНСПОЗИЦИЯ И КЛОНИРОВАНИЕ
31.8. В лаборатории можно сконструировать новые геномы и клонировать их в клетках-хозяевах
Разработанная в последние годы технология рекомбинантных ДНК - важнейшее достижение молекулярной биологии. Появилась возможность создать в лабораторных условиях новые комбинации неродственных генов. Затем эти новые геномы можно ввести в подходящие клетки и размножить во много раз с помощью механизмов синтеза ДНК клетки-хозяина. Некоторые из таких введенных в клетки генов могут также транскрибироваться и транслироваться в новом окружении. Основные этапы клонирования ДНК сводятся к следующему (рис. 31.17).
Рис. 31.17. Синтез и клонирование рекомбинантных молекул ДНК
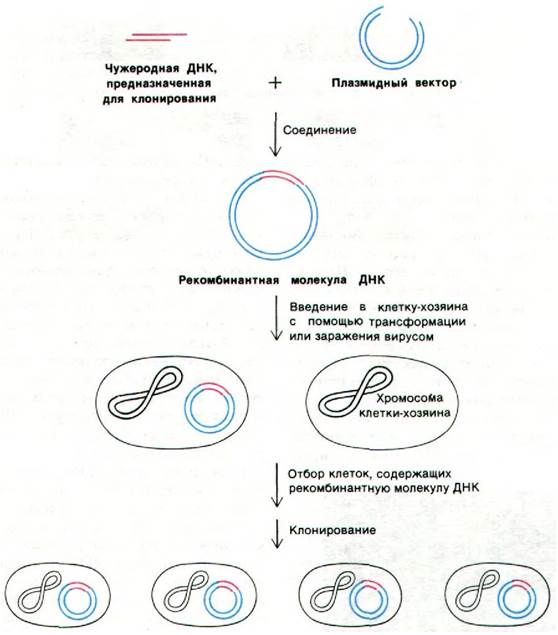
1. Создание рекомбинантной молекулы. Интересующий исследователя фрагмент ДНК ковалентно присоединяется к ДНК вектора. Основное свойство вектора состоит в том, что он может автономно реплицироваться в подходящем хозяине. Например, плазмиды и фаг X наиболее удобные векторы для клонирования генов в клетках Е. coli. Как будет описано ниже, молекулы ДНК можно соединить путем лигирования (т.е. воздействием лигазы) фрагментов с липкими одноцепочечными концами или же с тупыми концами.
Химерная ДНК - рекомбинантная молекула ДНК, содержащая неродственные гены. От слова химера - мифологическое существо с головой льва, телом козла и хвостом змеи. «...Коей порода была от богов, не от смертных: Лев головою, задом дракон и коза серединой. Страшно дыхала она пожирающим пламенем бурным». Гомер, «Илиада», пер. Н. Гнедича, гл. VI, стих 180.
2. Введение в клетку-хозяина. Большинство бактериальных и эукариотических клеток поглощает голые молекулы ДНК из среды. Эффективность поглощения низка (примерно 1 на 106молекул ДНК), но в специально подобранных экспериментальных условиях можно трансформировать значительную часть клеток. Существует и другой метод: клетки заражают реконструированными вирионами, содержащими рекомбинантные молекулы ДНК. В таком синтетическом вирусном геноме интересующий исследователя ген замещает участок вирусной ДНК, не имеющий существенного значения для репликации.
3. Отбор. Следующий этап состоит в том, чтобы определить, какие клетки несут рекомбинантную молекулу ДНК, содержащую нужный ген. Такие клоны можно отобрать по признаку присутствия вектора или самого встроенного гена. Например, некоторые плазмидные векторы сообщают клетке устойчивость к какому-либо антибиотику. Другой подход состоит в том, чтобы определить, какие клетки связывают РНК, комплементарную нужному гену, или синтезируют кодируемый им белок. Клоны, содержащие рекомбинантную ДНК, стабильны, по крайней мере в течение нескольких сотен поколений.
Клонирование рекомбинантной ДНК уже внесло большой вклад в наши представления о структуре хромосомы и выражении гена. Многие встроенные гены удалось размножить путем клонирования, что дало большие количества ДНК для определения последовательности оснований и электронно-микроскопических исследований. Кроме того, с помощью этих клонов были синтезированы в больших количествах белки, которые в обычных условиях образуются в ничтожных количествах. Методы рекомбинантных ДНК используются также для изучения сложных геномов и регуляции их выражения.
31.9. Ферменты рестрикции и ДНК-лигаза - необходимые инструменты для получения рекомбинантных молекул ДНК
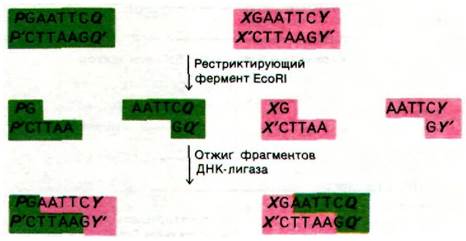
Молекулы ДНК можно легко соединять in vitro с помощью рестриктирующих эндонуклеаз (разд. 24.27), ДНК-лигаз (разд. 24.15) и других высокоспецифических ферментов, действующих на ДНК. В эксперименте по получению рекомбинантной ДНК вектор подготавливают к соединению с клонируемым фрагментом путем расщепления в одном определенном месте с помощью рестрикционной эндонуклеазы. Например, небольшую плазмиду pSC101 можно расщепить в одном месте ферментом рестрикции EcoR1. Если с помощью этого фермента две цепи ДНК расщепить наискосок, то образуются комплементарные одноцепочечные концы (липкие концы). Предположим теперь, что фрагмент ДНК, который необходимо ввести в эту плазмиду, образован путем расщепления большой молекулы ДНК эндонуклеазой EcoR1. Тогда одноцепочечные концы этого фрагмента будут комплементарны концам расщепленной плазмиды. Теперь фрагмент ДНК и плазмиду можно подвергнуть отжигу и соединить ДНК-лигазой (рис. 31.19). Затем бактерии инкубируют в присутствии этой смеси молекул ДНК. Небольшую часть бактерий, несущих плазмиду, отбирают, исходя из того, что pSC101 сообщает клеткам устойчивость к тетрациклину. Затем используют другой метод отбора для выявления клонов, содержащих плазмиду со встроенной ДНК.
Рис. 31.18. Электронная микрофотография pSC101 - плазмидного вектора, использованного для клонирования ДНК
Рис. 31.19. Соединение молекул ДНК с помощью метода липких концов. Одна из родительских молекул ДНК (показано зеленым цветом) несет гены Р и Q, разделенные участком рестрикции, а другая (красный цвет) несет гены X и У. Одна из рекомбинантных молекул несет гены Р и У, а другая - Q и X
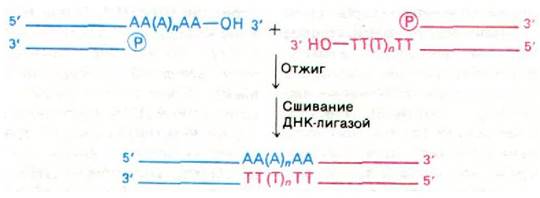
Второй метод соединения двух неродственных молекул ДНК основан на присоединении poly(dА)-фрагментов к обоим 3'-концам одной молекулы и poly(dТ)-фрагментов к обоим 3'-концам другой молекулы (рис. 31.20). Эти гомополимерные последовательности синтезируются терминальной дезоксинуклеотидил-трансферазой (терминальной трансферазой) - ферментом, присоединяющим нуклеотиды к 3'-гидроксильной группе цепи ДНК. Эта трансфераза в отличие от ДНК-полимеразы не зависит от матрицы, поэтому с ее помощью можно присоединить последовательности из нуклеотидов только одного тина (обычно длиной 100 остатков). Роlу(dА)-концы одной молекулы ДНК отжигают с poly(dT)-концами другой. Длины этих концевых последовательностей могут несколько колебаться, поэтому, прежде чем соединить цепи ДНК- лигазой, бреши заполняют с помощью ДНК-полимеразы I. Точно так же можно использовать для соединения различных молекул ДНК и концевые poly(dG)- и poly(dC)- последовательности.
Рис. 31.20. Соединение молекул ДНК с помощью наращивания poly (dA)- и poly(dT)-концов (коннекторным методом)
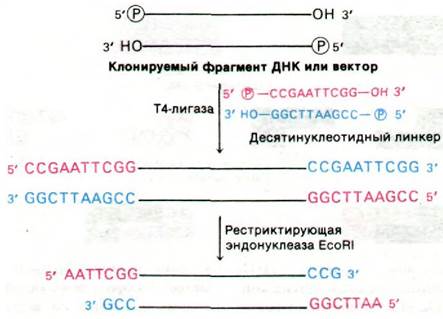
Третий подход к соединению молекул ДНК сочетает преимущества метода липких концов с универсальным характером (dА—dТ)-метода (коннекторного). К концам фрагмента ДНК или вектора ковалентно присоединяют химически синтезированный линкер, т.е. связующую цепь (длиной от шести до десяти пар оснований), чувствительный к расщеплению каким-либо ферментом рестрикции. 5'-концы десятинуклеотидного линкера и молекулы ДНК фосфорилируют полинуклеотидкиназой и соединяют лигазой фага Т4, которая может образовывать ковалентную связь между молекулами ДНК с тупыми концами. Если обработать эти концевые участки соответствующим ферментом рестрикции, образуются липкие концы (рис. 31.21). Таким образом, почти у любой молекулы ДНК можно вызвать образование липких концов, соответствующих специфичности данного фермента рестрикции.
Рис. 31.21. Образование липких концов путем присоединения и расщепления химически синтезированного линкера
31.10. Плазмиды и фаг лямбда - наиболее подходящие векторы для клонирования ДНК в бактериях
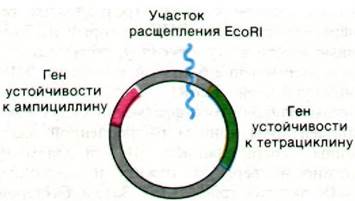
Для увеличения эффективности проникновения рекомбинантных ДНК в клетку и облегчения отбора содержащих такие молекулы бактерий создаются новые векторы. Например, плазмида рBR322 содержит гены устойчивости к тетрациклину и ампициллину (сходный с пенициллином антибиотик). Эту плазмиду пять различных рестриктаз расщепляют в каком-то одном определенном месте каждая (рис. 31.22). Введение ДНК в участок рестрикции EcoRl не затрагивает генов устойчивости к антибиотикам. В то же время введение ДНК в участки рестрикции HindIII, Sali или BamHI приводит к инактивации гена устойчивости к тетрациклину; это явление называется инактивацией вставкой (инсерционной инактивацией). Клетки, содержащие pBR322 со вставленной ДНК, устойчивы к ампициллину, но чувствительны к тетрациклину; поэтому их легко отобрать. Клетки, которые не смогли воспринять ДНК вектора, чувствительны к обоим антибиотикам, а клетки, содержащие pBR322 без вставки ДНК, к обоим антибиотикам устойчивы.
Рис. 31.22. Генетическая карта плазмиды рBR322, несущей два гена устойчивости к антибиотикам
Другая группа векторов создана на основе плазмиды ColEl, кодирующей колицин Е - белковый токсин, убивающий некоторые штаммы Е. coli. Преимущество использования этих колициногенных плазмид в качестве векторов состоит в том, что их репликация не находится под строгим контролем. В клетке, содержащей ColE1, обычно имеется 25 копий плазмиды. Обработка клеток хлорамфениколом блокирует синтез белка и репликацию клеточной хромосомы. Однако репликация ColE1 в этих условиях продолжается. В результате в клетках, обработанных хлорамфениколом, может накапливаться 1000 копий ColE1, так что количество этой плазмиды достигает примерно половины всей клеточной ДНК1.
1 Плазмида pBR322 создана на основе ColE1, поэтому она обладает способностью точно так же накапливаться в клетках в присутствии хлорамфеникола. Прим. перев.
Рис. 31.23. Электронная микрофотография плазмид ColE1
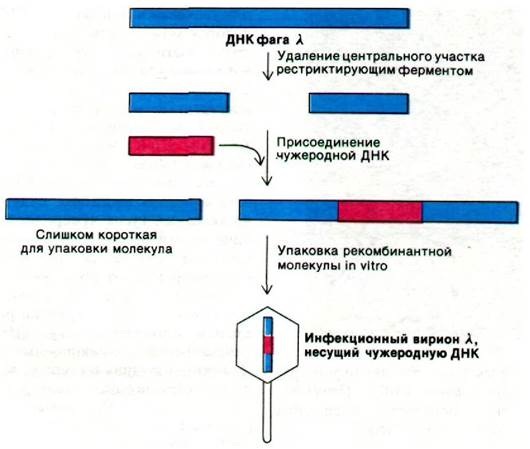
Фаг ![]() - другой удобный вектор. Большие участки его ДНК, имеющей в длину 48 kb, не являются необходимыми для литической инфекции или интеграции и могут быть замещены чужеродной ДНК. Были сконструированы мутантные фаги
- другой удобный вектор. Большие участки его ДНК, имеющей в длину 48 kb, не являются необходимыми для литической инфекции или интеграции и могут быть замещены чужеродной ДНК. Были сконструированы мутантные фаги ![]() , предназначенные для клонирования ДНК. Один из этих мутантов, который называется
, предназначенные для клонирования ДНК. Один из этих мутантов, который называется ![]() gt =
gt = ![]() , содержит два участка расщепления EcoR1 вместо пяти, имеющихся в фаге дикого типа (рис. 31.24). После расщепления центральный участок молекулы ДНК этого фага
, содержит два участка расщепления EcoR1 вместо пяти, имеющихся в фаге дикого типа (рис. 31.24). После расщепления центральный участок молекулы ДНК этого фага ![]() можно удалить. Два оставшихся куска ДНК составляют вместе 72% длины всего генома. Это количество ДНК недостаточно для упаковки в головку фага
можно удалить. Два оставшихся куска ДНК составляют вместе 72% длины всего генома. Это количество ДНК недостаточно для упаковки в головку фага ![]() . Длина ДНК, которая может быть легко упакована в головку, достигает 75-105% длины генома дикого типа. Однако достаточно длинный фрагмент ДНК (скажем, длиной 10 kb), вставленный между двумя концами ДНК фага
. Длина ДНК, которая может быть легко упакована в головку, достигает 75-105% длины генома дикого типа. Однако достаточно длинный фрагмент ДНК (скажем, длиной 10 kb), вставленный между двумя концами ДНК фага ![]() , позволяет такой рекомбинантной молекуле ДНК (93% генома) быть упакованной в головке (инкапсидироваться). Почти все инфекционные частицы X, образованные таким способом, будут содержать вставленный кусок чужеродной ДНК. Еще одно преимущество использования этих вирионов в качестве векторов состоит в том, что они проникают в бактерии с гораздо более высокой эффективностью, чем плазмиды. К настоящему времени разработаны методы упаковки молекул ДНК in vitro с образованием инфекционных вирионов X. Для использования в качестве векторов были сконструированы самые разнообразные мутанты фага X. Некоторые из них могут служить векторами для вставок фрагментов ДНК, достигающих 40 kb.
, позволяет такой рекомбинантной молекуле ДНК (93% генома) быть упакованной в головке (инкапсидироваться). Почти все инфекционные частицы X, образованные таким способом, будут содержать вставленный кусок чужеродной ДНК. Еще одно преимущество использования этих вирионов в качестве векторов состоит в том, что они проникают в бактерии с гораздо более высокой эффективностью, чем плазмиды. К настоящему времени разработаны методы упаковки молекул ДНК in vitro с образованием инфекционных вирионов X. Для использования в качестве векторов были сконструированы самые разнообразные мутанты фага X. Некоторые из них могут служить векторами для вставок фрагментов ДНК, достигающих 40 kb.
Рис. 31.24. В качестве вектора для клонирования может быть использован мутант фага X. В ходе реакции упаковки фага происходит отбор молекул ДНК, содержащих вставку