БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 32. ОБОЛОЧКИ БАКТЕРИАЛЬНЫХ КЛЕТОК
32.9. Пенициллин вызывает гибель растущих бактерий, ингибируя синтез клеточных стенок
Пенициллин был открыт в 1928 г. Александером Флемингом (Alexcander Fleming) довольно случайно.
При работе с различными штаммами стафилококка часть чашек с культурами откладывали в лабораторную коллекцию и время от времени просматривали. Поскольку, когда чашки просматривали, их приходилось открывать, в чашки неизбежно попадали из воздуха различные микроорганизмы. Обратили внимание на то, что вокруг большой колонии проросшей плесени колонии стафилококка стали прозрачными и явно подвергались лизису.
Плесень пересеяли и далее стали проводить предварительное изучение того бактериологического вещества, которое, очевидно, синтезировалось плесенью и диффундировало в окружающую среду. Оказалось, что бульон, в котором на протяжении 1-2 недель при комнатной температуре культивировали плесень, приобретал выраженные ингибирующие, бактерицидные и бактериолитические свойства в отношении многих распространенных патогенных бактерий.
Далее было обнаружено, что экстракт из плесени Pinicillium при введении животным не оказывал заметного токсического действия. Это послужило стимулом для дальнейших исследований. Однако, когда Флеминг попытался сконцентрировать и очистить активный антибиотик, по его словам, оказалось, что «пенициллин легко разрушается, и, несмотря на все усилия, мы потерпели неудачу. Мы были бактериологи, а не химики, и наши относительно простые приемы не принесли успеха».
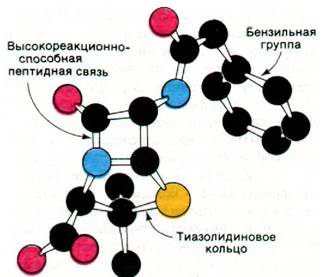
Прошло 10 лет, прежде чем к пенициллину вернулись снова. Патолог Хоуард Флори (Howard Florey) и биохимик Эрнст Чейн (Emst Chain) провели ряд глубоких исследований, итогом которых явилось выделение, химическая характеристика и клиническое использование этого антибиотика. Пенициллин состоит из тиазолидинового кольца, сочлененного с β-лактамным кольцом, в одном из положений которого находится тот или иной заместитель (R), присоединенный с помощью пептидной связи. В бензилпенициллине, например, R является бен- зильной группой (рис. 32.13 и 32.14). Эта структура может подвергаться различным трансформациям, что служит причиной лабильности пенициллина, с которой впервые столкнулся Флеминг. Особенно неустойчиво ß-лактамное кольцо. Как будет показано ниже, это свойство имеет прямое отношение к антибиотической активности пенициллина.
Рис. 32.13. Высокореакционноспособный участок пенициллина - пептидная связь β-лактамного кольца. В положении R могут стоять различные заместители (вариабельная группа); в бензилпенициллине R - бензильная группа
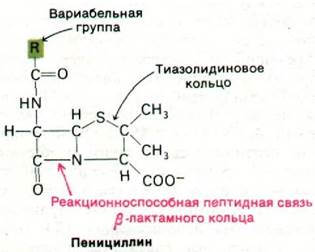
Рис. 32.14. Модель бензилпенициллина
В 1957 г. Джошуа Ледерберг (Joshua Lederberg) показал, что бактерии, в обычных условиях чувствительные к пенициллину, могут расти в присутствии этого антибиотика, если используется гипертоническая среда. Выращенные таким образом микроорганизмы, так называемые протопласты, лишены клеточных стенок и потому при переносе в обычную среду подвергаются лизису. Отсюда был сделан вывод, что пенициллин препятствует синтезу клеточных стенок бактерий. В 1965 г. Джеймс Парк и Джек Стромингер (James Park, JackStrominger) независимо друг от друга пришли к выводу, что пенициллин блокирует последний этап биосинтеза, а именно образование поперечных сшивок.
32.10. Пенициллин блокирует синтез клеточных стенок путем ингибирования реакции транспептидирования
Пенициллин ингибирует транспептидазу, поперечно сшивающую цепи протеоглика на:
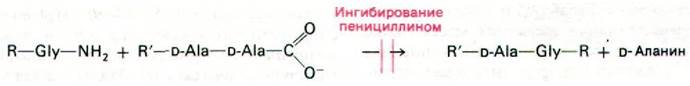
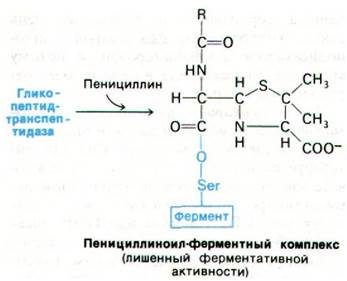
При нормальном течении реакции транспептидаза образует в качестве промежуточного продукта ацильное производное с остатком D-аланина в предпоследнем положении пептида (рис. 32.15). Этот промежуточный продукт взаимодействует далее с аминогруппой концевого глицина другого пептида. Как показали недавно проведенные исследования, пенициллин ингибирует транспептидазу путем образования ковалентной связи с остатком серина в активном центре фермента (рис. 32.16). Комплекс пеницилли- ноил-фермент не подвергается деацилированию. В результате ингибирование транспептидазы пенициллином оказывается необратимым.
Рис. 32.15. В ходе реакции транспептидирования в качестве промежуточного продукта образуется ацил—фермент
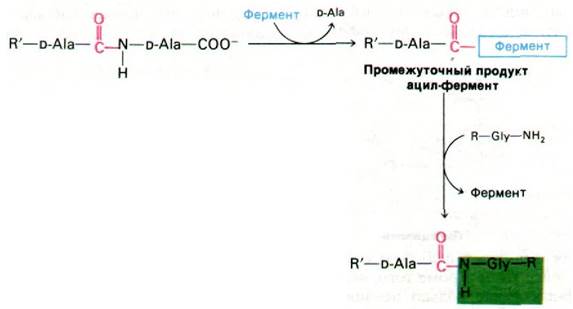
Рис. 32.16. Образование пенициллином ферментного комплекса, обладающего неограниченной стабильностью
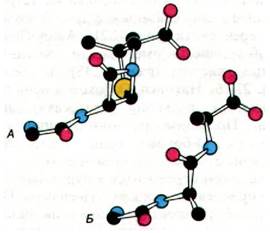
Почему пенициллин является столь эффективным ингибитором транспептидазы? С помощью молекулярных моделей было выявлено, что пенициллин сходен с одним из субстратов фермента, а именно с ацил-D- Ala-D-Ala (рис. 32.17). Кроме того, четырехчленное β-лактамное кольцо пенициллина имеет напряженную конформацию, вследствие чего пептидная связь в нем становится высокореакционноспособной. В сущности, пенициллин имеет, по-видимому, структуру переходного состояния нормального субстрата этого фермента. Другими словами, пенициллин - аналог переходного состояния.
Рис. 32.17. Конформация пенициллина в области высокореакционноспособной пептидной связи(А) сходна с предполагаемой конформацией структуры R-D- Ala-D-Ala (Б) в переходном состоянии при протекании реакции транспептидирования
Любопытно сравнить пенициллин с другими необратимыми ингибиторами ферментов. Стабильный, неактивный пенициллиноил-ферментный комплекс совершенно аналогичен фосфорил-ферментному комплексу, образующемуся при взаимодействии органических фторфосфатов с ацетилхолинэстеразой или сериновыми протеиназами. Однако специфичность пенициллина намного выше, чем у фторфосфатных ингибиторов. Мишень действия пенициллина очень строго задана его структурным сходством с концевым участком D-Аlа-D-Аlа новообразующейся цепи пептидогликана. Следствием этой исключительной специфичности является низкая токсичность пенициллина, столь ценная при клиническом использовании. В организме человека нет ни одного фермента, распознающего D-Ala-D-Ala, а потому пенициллин не может помешать работе наших ферментов.
32.11. Некоторые бактерии резистентны к пенициллину, так как синтезируют разрушающий его фермент
Ряд бактерий синтезирует пенициллиназу - фермент, способный расщеплять амидную связь в β-лактамном кольце пенициллина с образованием пенициллоиновой кислоты, лишенной антибиотической активности:
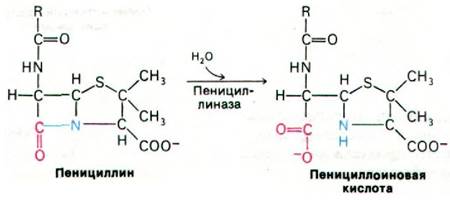
Был выделен целый ряд близких по структуре пенициллиназ, имеющих массу около 30 кДа и высокое число оборотов (порядка 103 с-1). Активность фермента в значительной мере зависит от природы R-группы, присоединенной к β-лактамному кольцу пенициллина. Поэтому полусинтетические пенициллины с R-группами, защищающими их от действия пенициллиназы, представляют большую ценность для клинических целей.
Ген, кодирующий пенициллиназу, локализован в различных плазмидах (разд. 31.6). Эти внехромосомные генетические элементы у некоторых видов бактерий способны быстро появляться и исчезать. В ряде бактериальных штаммов пенициллиназа является индуцируемым ферментом. По-видимому, пенициллиназа возникла в ходе эволюции как механизм детоксикации, поскольку она свойственна только микроорганизмам, клеточная стенка которых образована пептидогликаном. Судя по тому, что утрата гена пенициллиназы не вызывает повреждения клетки в отсутствие антибиотика, у фермента, видимо, нет иной функции, кроме инактивации пенициллина. К тому же имеется хорошая корреляция между степенью устойчивости к действию пенициллина и общей пенициллиназной активностью.