БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 33. ИММУНОГЛОБУЛИНЫ
33.11. Каждая L- и Н-цепь состоит из вариабельного и константного участков
При множественной миеломе в моче больных, как правило, появляются большие
количества аномальных белков. На эти белки обратил внимание еще в 1847 г. Генри Бенс-Джонс (Henry Bence-Jones) в связи с их необычными свойствами: они выпадают в осадок при нагревании до 50°С и вновь растворяются при кипячении. Оказалось, что белок Бенс-Джонса - это димер L-цепей иммуноглобулина, продуцируемого миеломой больного; этот белок послужил удобным исходным материалом для анализа последовательности аминокислот в L-цепях.
В 1965 г. было проведено первое полное определение последовательностей аминокислот в миеломных L-цепях, содержащих 214 аминокислотных остатков. Эти исследования показали, что у разных больных белки Бенс-Джонса различаются по последовательности аминокислот. Самое удивительное состояло в том, что различия касались только N-концевой половины полипептидных цепей. Каждый из исследованных белков Бенс-Джонса характеризовался уникальной последовательностью аминокислот в положениях от 1 до 108, но начиная с положения 109, последовательность ряда белков Бенс-Джонса была идентичной. Следовательно, L-цепи состоят из вариабельного участка (остатки 1-108) и константного (постоянного) участка (остатки 109-214). Такое явление не имело прецедента в белковой химии.
Не все L-цепи имеют один и тот же константный участок. Существует два типа L-цепей, обозначаемых соответственно каппа (ӽ) и лямбда (![]() ), которые во многом сходны между собой. Так, оба типа L-цепей состоят из 214 остатков, содержат вариабельную N-концевую и константную С-концевую половины. Каждая из половин ӽ- и
), которые во многом сходны между собой. Так, оба типа L-цепей состоят из 214 остатков, содержат вариабельную N-концевую и константную С-концевую половины. Каждая из половин ӽ- и ![]() - цепей образует петлю из-за наличия внутрицепочечной дисульфидной связи. С-концевым остатком цепей обоих типов является цистеин, который участвует в образовании дисульфидного мостика с Н-цепью. Наконец, ӽ- и
- цепей образует петлю из-за наличия внутрицепочечной дисульфидной связи. С-концевым остатком цепей обоих типов является цистеин, который участвует в образовании дисульфидного мостика с Н-цепью. Наконец, ӽ- и ![]() -цепи содержат идентичные аминокислотные остатки в 40% положений, т. е. проявляют примерно такую же степень гомологии, как α- и β-цепи гемоглобина человека.
-цепи содержат идентичные аминокислотные остатки в 40% положений, т. е. проявляют примерно такую же степень гомологии, как α- и β-цепи гемоглобина человека.
Константные участки всех х-цепей идентичны, за исключением положения 191, где может стоять либо лейцин, либо валин. Это аллотипическое различие наследуется по классическому правилу Менделя. К-Цепи также вариабельны по положению 191, где может стоять лизин или аргинин.
Н-цепи содержат 446 аминокислотных остатков. Сравнение последовательностей Н-цепей иммуноглобулинов, продуцируемых разными миеломами, выявило, что и в этом случае вариабельными оказываются первые 108 остатков (от N-конца). Следовательно, тяжелые цепи, подобно легким, состоят из вариабельной (V) и константной (С) области. Вариабельные области Н- и L- цепей но размеру одинаковы, а константные - различны: в Н-цепях этот участок в 3 раза длиннее, чем в L-цепях (рис. 33.13).
Рис. 33.13. Тяжелая цепь IgG также состоит из вариабельной и константной областей

33.12. Участок связывания антигена образован гипервариабельными фрагментами L- и Н-цепей
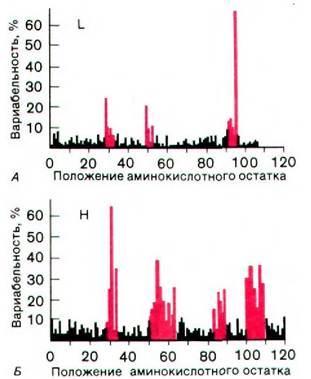
Как уже упоминалось выше, в состав антигенсвязывающего фрагмента Fab полностью входит L-цепь и частично - Н-цепь. Каков относительный вклад каждой из этих цепей в связывающую активность? Первые сведения в этом отношении были получены при сравнении последовательностей аминокислот в большом числе миеломных белков. Обнаружилось, что вариабельные области L- и Н-цепей вовсе не равномерно вариабельны, а именно три участка L-цепи и четыре Н-цепи проявляют значительно большую изменчивость, чем другие части вариабельных областей (рис. 33.14). В 1970 г. Элвин Кабат (Elwin Kabat) предположил, что эти гипервариабельные участки образуют область, связывающую антиген, и что именно от природы составляющих их аминокислот зависит специфичность антитела.
Рис. 33.14. Гипервариабельные участки легких (А) и тяжелых (Б) цепей. Степень вариабельности в последовательности аминокислот отложена как функция положения аминокислоты
Для проверки этой гипотезы были проведены опыты с использованием аффинной метки. Гаптены, содержащие реакционноспособные группы, синтезируются просто. Реакционноспособный гаптен специфически связывается с антигенсвязывающим участком антитела и далее образует ковалентную связь с ближайшим подходящим остатком в молекуле данного белка. Например, антитела против ДНФ можно пометить по антигенсвязывающему участку гаптеном нитро- фенилдиазонием:
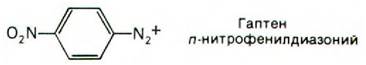
Диазониевая группа высокореакционноспособна и образует диазосоединения с остатками тирозина, гистидина и лизина. Модифицированные таким образом антитела содержат метку и в L-цепях и в Н-цепях. При этом меченые остатки оказались локализованными в гипервариабельных участках этих цепей. Следовательно, участки связывания антигена формируются гипервариабельными остатками аминокислот как L-цепей, так и Н-цепей. При последующем рентгеноструктурном анализе были получены более прямые данные в пользу этого положения; мы их обсудим ниже.
33.13. Вариабельная и константная области выполняют разные функции
N-концевые части легких и тяжелых цепей содержат вариабельные области, ответственные за связывание антигена. Различиями в последовательности аминокислот обусловлено формирование участков, связывания антигена, различающихся по специфичности. Остальная часть каждой из цепей - константная; она осуществляет такие эффекторные функции, как связывание комплемента и перенос антител через плацентарную мембрану. Одни и те же эффекторные функции свойственны антителам
самой разной специфичности. Таким образом, антитела состоят из участка с уникальной последовательностью аминокислот, определяющей специфичность связывания антигена, и из участка с постоянной последовательностью, осуществляющего общие эффекторные функции. Поразительная особенность структуры иммуноглобулинов состоит в том, что вариабельный и константный области в легких и тяжелых цепях имеют четкую границу раздела.
33.14. Молекулы антител уложены с образованием компактных доменов, имеющих гомологичные последовательности
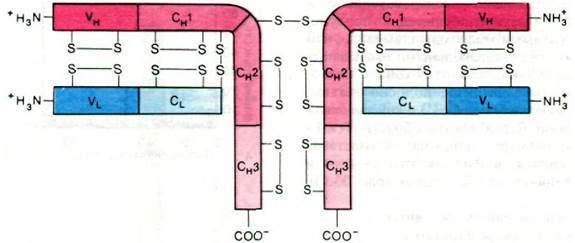
Последовательность аминокислот в молекуле иммуноглобулина полностью раскрыл в 1968 г. Джералд Эделман (Gerald Edelman). Самая интересная особенность этой последовательности состоит в периодичности расположения внутрицепочечных дисульфидных связей и в легких, и в тяжелых цепях (рис. 33.15). Кроме того, имеется сходство в последовательности аминокислот разных частей молекулы иммуноглобулина. Так, вариабельная область легкой цепи (VL) гомологична вариабельной области тяжелой цепи (VH); константная область тяжелой цепи (СH) состоит из трех равных частей (СH1 СH2 и СH3), обладающих сходными последовательностями; на
конец, константная область легкой цепи (CL) гомологична трем доменам константной области тяжелой цепи.
Рис. 33.15. Структура IgG. Показано расположение дисульфидных мостиков и участки гомологичных последовательностей
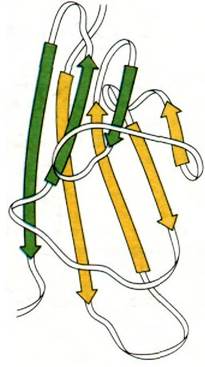
Эта очевидная гомология последовательностей аминокислот свидетельствует о том, что молекулы иммуноглобулинов свернуты с образованием компактных доменов, каждый из которых содержит область, гомологичную по крайней мере одному активному участку, выполняющему определенную функцию, свойственную молекуле иммуноглобулина в целом (рис. 33.16). Представляется вероятным, что домены сходны по четвертичной структуре, поскольку сходны их последовательности аминокислот. Данные рентгеноструктурного анализа подтвердили гипотезу доменов. Роберто Поляк (Roberto Poljak) раскрыл пространственную структуру при разрешении 2,0 А фрагмента Fab'(практически идентичного фрагменту Fab) человеческого иммуноглобулина. Фрагмент Fab'состоит из четырех расположенных в виде тетраэдра глобулярных субъединиц - VL, VH, CL и СН1 - поразительно сходных по пространственной структуре (рис. 33.17). Общая структурная особенность четырех доменов состоит в наличии двух широких антипараллельных β-складок (рис. 33.18). Между ними располагаются плотно упакованные боковые цепи многих гидрофобных остатков. Указанный повторяющийся элемент структуры назван иммуноглобулиновой складкой.
Рис. 33.16. Схема, иллюстрирующая гипотезу доменов
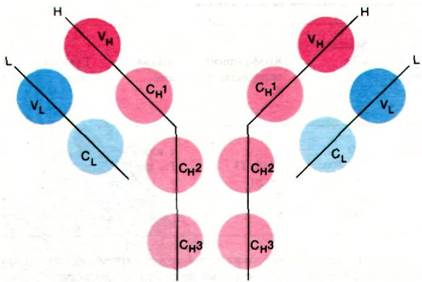
Рис. 33.17. Структура Fab-фрагмента; показаны только α-углеродные атомы. L-цепи изображены синим цветом, Н-цепи - красным
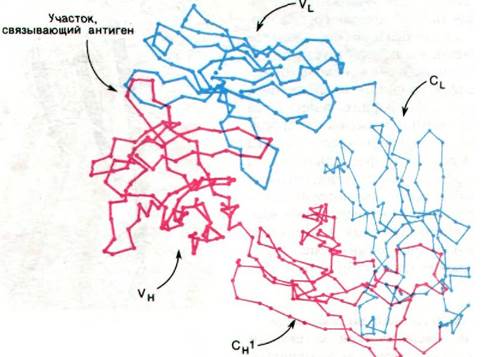
Рис. 33.18. Два слоя антипараллельных β-складок (показаны зеленым и желтым цветом) составляют основной структурный мотив доменов в иммуноглобулинах
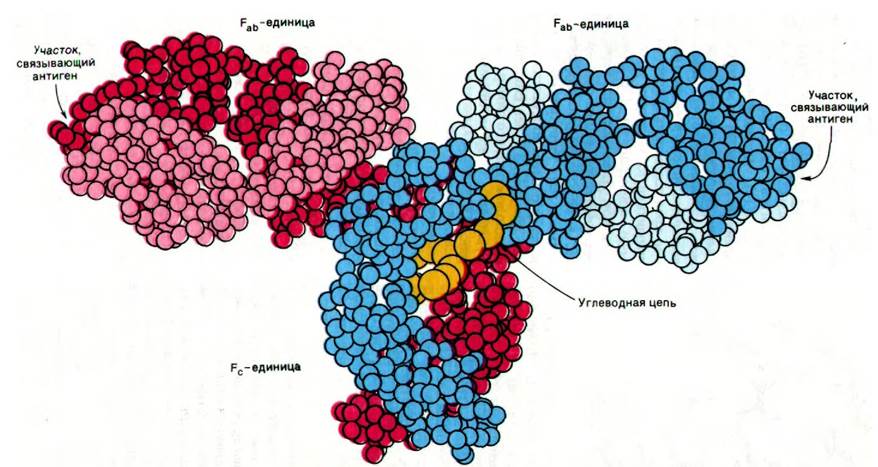
Трехмерную структуру интактного иммуноглобулина G раскрыл Дэвид Дэвис (David Davies). Анализ карты электронной плотности с разрешением 6 А показал, что молекула IgG имеет Т-образную форму (рис. 33.19). Домены в фрагменте Fc, так же, как и в фрагменте Fab, имеют характерную иммуноглобулиновую складку. Углеводный компонент, ковалентно связанный с остатком аспарагина в СH2-домене, расположен между доменами СH1 и СH2 (рис. 33.19) и составляет значительную часть области контакта между единицами Fab и Fc. Сравнение взаимной ориентации прилегающих друг к другу доменов в разных иммуноглобулинах и их фрагментах показало, что полипептидные цепи между доменами обладают значительной гибкостью.
Рис. 33.19. Схематическое изображение трехмерной структуры молекулы IgG. Каждый аминокислотный остаток изображен в виде шарика. Одна из Н-цепей показана красным цветом, другая синим. Одна из L-цепей показана розовым цветом, другая голубым. Углеводная цепь присоединена к домену СН2 (показана желтым цветом)