Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Предсказание функции белка по свойствам его поверхности
Белок-белковый интерфейс
Активные точки белковых интерфейсов
Показано, что определенные остатки интерфейса при мутации на аланин (процедура, называемая аланин-сканирующим мутагенезом) гораздо сильнее влияют на стабильность комплекса, чем другие остатки интерфейса белка (Clackson and Wells 1995). Наиболее важные аминокислоты, называемые “активными” остатками, стремятся расположиться в глубине карманов на поверхности белка (Bogan and Thom 1998). Остальная поверхность карманов выстлана аминокислотами средней важности. Большинство активных остатков, определенных таким образом, хранится в базе данных ASEdb (Thom and Bogan 2001). Анализ этих остатков предполагает, что чаще активный остаток является большим и ароматическим (как триптофан или тирозин) или положительно заряженным аргинином (но не лизином). Менее вероятно, что активные остатки будут небольшими амфифильными (серин, треонин), либо гидрофобными (валин и лейцин) (Bogan and Thom 1998).
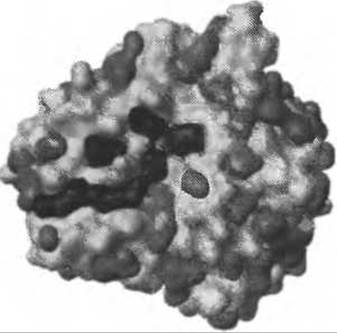
Рис. 7.6. Поверхность ДНКазы I (обозначена белым, PDB код 1ATN) в комплексе с актином (не показан), со всеми предсказанными с помощью программы Q-SiteFinder карманами (серые/черные). Карманы, окрашенные в черный, соответствуют тем, в которых находятся атомы актина
Анализ карманов на интерфейсах позволяет предположить, что наиболее существенное различие между такими карманами и карманами в остальной части белка заключается в том, что первые заметно легче десольватируются (Burgoyne and Jackson 2006). Авторы использовали программу обнаружения карманов Q-SiteFinder (Раздел 7.4.2.3, Рис. 7.6) для определения всех карманов на поверхности. Затем они были ранжированы в соответствии с различными свойствами поверхности.
Ранжирование по десольватации с наибольшим успехом позволяет явно выделить карманы на интерфейсах среди остальных карманов белка. По легкости десольватации ароматические и алифатические поверхности превосходят полярные и, что более важно, заряженные поверхности, которые являются наименее легко десольватируемыми. Это позволяет предположить, что активные остатки, вероятно, необходимы для облегчения десольватации при связывании или для удаления воды из карманов. Может показаться странным включение аргинина в число активных остатков, поскольку он должен бы быть трудно дельсоватируем из-за своего заряда, однако если для молекулярного распознавания на интерфейсе необходим положительно заряженный остаток, то его гуанидиновая группа намного проще десольватируема по сравнению с аминогруппой лизина. Также было предположено, что гидрофобное окружение может уменьшать эффективную диэлектрическую константу в области локализации важных водородных связей, усиливая тем самым взаимодействие (Bogan and Thom 1998). Стоит также отметить, что активные остатки могут быть в числе наиболее консервативных остатков в семействе белков (Ma et al. 2003), но эта консервативность, как правило, сохраняется только при множественном выравнивании последовательностей, когда взаимодействующие белки в выравнивании являются интерлогами (интерлогами называются взаимодействующие белки, чьи гомологи из организмов других видов также могут взаимодействовать).