БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.10.Біосинтез білка
6.10.4.Рибосоми: будова й функції
Рибосомами називають найдрібніші немембранні клітинні органели рибонуклепротеїнової природи, залучені до процесу синтезу білкових молекул як у прокаріотів, представлених в основному бактеріями, так і в еукаріотів - тварини, рослини, гриби. У прокаріотів рибосоми розсіяні по протоплазмі й становлять до 30-40 % сухої маси бактерій, а їхня кількість варіює (1-7) · 104 на клітину; в еукаріотів вміст рибосом не перевищує 5 % за масою. У цитоплазмі виділяють дві основні ділянки трансляції: вільні рибосоми та рибосоми, зв'язані з ендоплазматичним ретикулумом. Останні синтезують головним чином секреторні та мембранні білки, тоді як на вільних рибосомах синтезуються білки для внутрішньоклітинних потреб. Для еукаріотів характерні також рибосоми, асоційовані з цитоскелетом, і спеціальні рибосоми в мітохондріях і хлоропластах.
Рибосоми - це компактні часточки специфічної форми, які не мають внутрішньої й зовнішньої симетрії, нагадують сферу діаметром 18 нм з молекулярною масою 2,7 · 106 (у прокаріотів) і діаметром 23 нм з молекулярною масою 4,2 -10б (в еукаріотів). Згідно з величиною константи седиментації, яка залежить від розміру часточок, їхньої форми та щільності, рибосоми поділяють на 70S - прокаріотичні та 80S - еукаріотичні. Рибосоми хлоропластів вищих рослин належать до 70S типу. Мітохондріальні рибосоми грибів мають коефіцієнт седиментації 75S, а мітохондрії ссавців містять міні-рибосоми (55S), хоча функціонально вони подібні до 70S рибосом прокаріотів.
Рибосоми є рибонуклеопротеїновими часточками, стабільність яких підтримується за певних концентрацій іонів М§2+ (1·10-3моль/л) та інших катіонів, поліамінів. 70Sпрокаріотичні рибосоми містять у середньому 65 % рРНК і 35 % білка, а у 80S рибосомах еукаріотів це співвідношення майже 1 : 1. Дані про склад рибосом наведено на рис. 6.36.
Прокаріотичні 70S рибосоми складаються з великої 50S і малої 30S субодиниць. Мала субодиниця містить високополімерну 16S рРНК і 21 білок, її позначають S (від англ. Small - малий). Велика 50S субодиниця складається з високополімерної 23S рРНК, 5S рРНК, 36 білків і позначається L (від англ. Large - великий). Первинну структуру майже всіх білків E. coli встановлено й доведено її унікальність. Усі білки різні за розмірами та структурою, їхня молекулярна маса коливається від 6 ·103до 7,5 ·104.
![]()
Для 80S еукаріотичних цитоплазматичних рибосом характерний більший розмір і складніша структура. До складу 40S малої рибосомної субодиниці входять 18S рРНК і близько 33 білків. Велика 60S субодиниця містить високополімерну 28S рРНК, 5S рРНК та 5,8S рРНК і майже 50 білків (рис. 6.36).
Еукаріотичні та прокаріотичні рибосомні білки - це в основному асиметричні глобулярні компактні молекули, що містять α-спіралі й β-шари, а також витягнуті нерегулярні ділянки. Зв'язки між рРНК і білками в рибосомі оцінюють в основному як електростатичні. За рахунок високого вмісту позитивно заряджених амінокислотних залишків (лізину -12 %, аргініну - 11 %, гістидину - 3 %) у білкових молекулах забезпечується взаємодія з негативно зарядженими фосфатами у складі рРНК, що й структурує рибосому. Отже, рРНК формують ядро рибосомних субодиниць і реалізують ряд активностей рибосом, а білкові кластери стабілізують їхні локальні структури, сприяючи цим набуттю активної конформації рРНК.
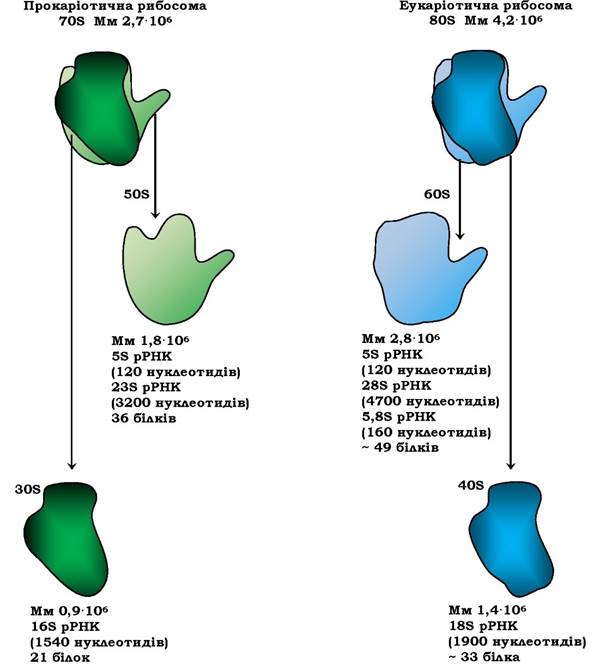
Рис. 6.36. Структурні характеристики про- та еукаріотичних рибосом
Принципового значення для пояснення функціонування рибосомного апарату клітини набули дані про локалізацію центрів, де проходять основні етапи біосинтезу поліпептидного ланцюга. Рентгеноструктурні кристалографічні дослідження з роздільною здатністю до 5,5 А виявили, що синтез білків здійснюється у площині між рибосомними субодиницями. У рибосомі є центри, пов'язані з субстратами реакції транспептидації. В аміноациль- ному (А-центрі) відбувається зв'язування антикодону аміноацил-тРНК з тим кодоном мРНК, який міститься в цьому центрі. У Р-центрі - пептидильному - проходить зв'язування пептидил-тРНК, тобто тієї тРНК, що акцептує пептид, який уже синтезовано. З Е-центру виходить деаміноацильована тРНК; у рибосомі функціонує також пептидилтрансферазний центр та центри локалізації мРНК і білкових факторів трансляції. Усе це свідчить, що структурно та функціонально рибосома є складною молекулярною машиною, яка послідовно сканує ланцюг мРНК і відповідно вибирає з цитоплазми ті аміноацил-тРНК, антикодони яких є комплементарними триплетним комбінаціям (кодонам) мРНК, що містяться в даний момент у рибосомі. Кодон- антикодонові взаємодії між мРНК і аміноацил-тРНК стабілізуються за рахунок стандартного уотсон-кріківського спарювання. Рух рибосоми вздовж мРНК задає строгий часовий порядок входження в рибосому певних аміноацил-тРНК. Амінокислотний залишок ковалентно приєднується до поліпептидного ланцюга, а деаміноацильована тРНК вивільняється з рибосоми.