БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 6. ОБМІН І ФУНКЦІЇ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКА
6.10.Біосинтез білка
6.10.10.Регуляція синтезу білка
Головною умовою існування живих організмів є узгоджене функціонування взаємопов'язаних елементів складної системи регуляції, особливо на рівні транскрипції та трансляції. Завдяки цьому відбувається адаптація організмів до нових умов: пристосування мікроорганізмів до навколишнього живильного середовища або складного багатоклітинного організму до нових фізіологічних потреб у змінених умовах перебування.
Клітини живих організмів мають здатність синтезувати велику кількість різноманітних білків, однак вони ніколи не синтезують відразу їх усі. Кількість і різноманітність білків, зокрема ферментів, визначаються ступенем їхньої участі в метаболізмі. Більше того, інтенсивність обміну регулюється швидкістю синтезу білка й паралельно контролюється алостеричним шляхом. Отже, синтез білка регулюється зовнішніми та внутрішніми факторами й умовами, за яких клітина синтезує таку кількість білків і такий їх набір, які необхідні для виконання певних фізіологічних функцій.
Загальну теорію регуляції синтезу білка розробили французькі вчені, лауреати Нобелівської премії 1965 р. в галузі фізіології і медицини Ф. Жакоб і Ж. Моно. Сутність цієї теорії зводиться до "вимикання" або "вмикання" генів як функціональних одиниць, до можливості або неможливості прояву їхньої здатності передавати закодовану в ДНК інформацію щодо синтезу специфічних білків. Запропонований тип регуляції, підтверджений в дослідах на бактеріях, був названий регуляцією синтезу білка на рівні транскрипції, оскільки зміна швидкості синтезу білка відбувається за рахунок зміни швидкості транскрипції генів, тобто на стадії утворення мРНК.
Дослідження на клітинах E. coli дозволили встановити, що в бактерій існують ферменти трьох типів:
✵ конститутивні - присутні в клітинах у постійній кількості незалежно від метаболічного стану організму;
✵ індуковані - їхня концентрація за звичайних умов мала, але може значно зростати (до 1000 разів і більше) при додаванні в культуральне середовище субстратів цього ферменту;
✵ репресовані - ферменти метаболічних шляхів, синтез яких зупиняється при додаванні в середовище кінцевого продукту функціонування цих шляхів.
Таким чином, у бактерій доведено індукцію ферментів (синтез ферментів de novo) при додаванні в середовище для культивування їхніх субстратів. Додавання кінцевих продуктів реакції, утворення яких каталізується цими самими ферментами, навпаки, викликає зменшення кількості синтезованих ферментів. Останнє явище отримало назву репресії синтезу ферментів. Обидва явища - індукція й репресія - є взаємозалежними.
Відповідно до теорії Ф. Жакоба й Ж. Моно в процес біосинтезу білка у бактерій залучено принаймні три типи генів: структурні, ген-регулятор і ген-оператор. Структурні гени визначають первинну структуру синтезованого білка. Саме вони в ланцюзі ДНК є основою для біосинтезу мРНК, яка потім надходить у рибосому і слугує матрицею для біосинтезу білка. Регуляцію синтезу білка шляхом індукції зображено на рис. 6.47.
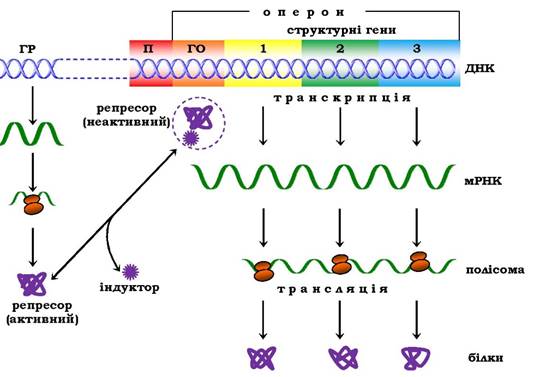
Рис. 6.47. Регуляція синтезу білка шляхом індукції (схема):
ГР - ген-регулятор; П - промотор; ГО - ген-оператор
Синтез мРНК на структурних генах безпосередньо контролюється певною ділянкою молекули ДНК, названою геном-опера- тором. Він є пусковим механізмом для функціонування структурних генів. Ген-оператор локалізований біля структурних генів, регульованих ним. Зчитування генетичного коду, тобто формування мРНК, починається з промотору - ділянки ДНК, розташованої поруч із геном-оператором, яка і є точкою ініціації синтезу мРНК, і далі йде послідовно вздовж оператора й структурних генів. Отже, транскрипція структурних генів залежить від здатності РНК-полімерази приєднуватись до промотору. Синтезовану молекулу мРНК, що кодує синтез кількох різних білків, називають полігенним (поліцистронним) транскриптом. Координований одним оператором один ген або група структурних генів (часто - це гени білків, функції яких тісно пов'язані в метаболічних процесах) утворюють оперон.
Робота оперона перебуває під контролюючим впливом іншої ділянки ланцюга ДНК - гена-регулятора. Структурні гени й ген- регулятор розташовані в різних ділянках ланцюга ДНК, тому зв'язок між ними, як припустили Ф. Жакоб і Ж. Моно, здійснюється за допомогою посередника - білка, названого репресором. Синтез репресора відбувається на матриці специфічної мРНК, синтезованої на гені-регуляторі (рис. 6.48). Репресор має постійну швидкість синтезу в клітині й високу спорідненість до гена- оператора, оборотно з'єднується з ним у комплексі. Утворення такого комплексу приводить до блокування синтезу мРНК, а отже, і синтезу білка, тобто функція гена-регулятора полягає в тому, щоб через білок-репресор припиняти роботу структурних генів, які синтезують мРНК. Структурні ділянки промотору й оператора можуть частково перекриватись, тому приєднання білка-репресора до оператора створює стеричні перешкоди для приєднання РНК-полімерази.
Репресор, крім того, має здатність строго специфічно зв'язуватися з певними низькомолекулярними речовинами - індукторами, або ефекторами. Якщо такий індуктор з'єднується з репресором, то останній втрачає здатність зв'язуватися з геном-опе- ратором, який виходить з-під контролю гена-регулятора, і врешті-решт починається синтез мРНК. Це типовий приклад негативної форми контролю, коли індуктор, з'єднуючись із білком- репресором, викликає зміни його третинної структури настільки, що репресор втрачає здатність зв'язуватися з геном-оператором.
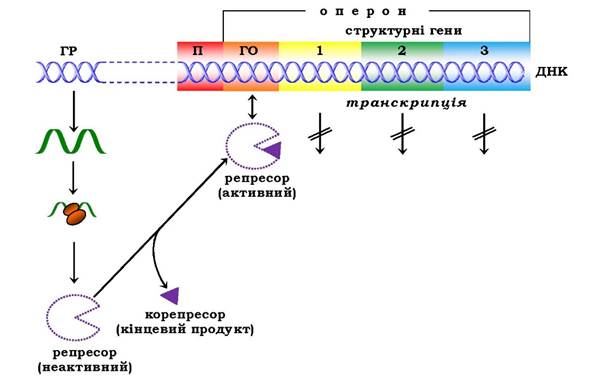
Рис. 6.48. Регуляція синтезу білка шляхом репресії:
ГР - ген-регулятор; П - промотор; ГО - ген-оператор
Механізми описаної регуляції синтезу білка та взаємодії реп- ресора зі структурними генами були запропоновані на основі даних з вивчення лактозного оперона (lac-оперона) Е. coli, де закодовано білки, які беруть участь у засвоюванні лактози. Одним із трьох білків, що забезпечують утилізацію лактози, є β-галактозидаза (лактаза) - фермент, що розщеплює молочний цукор на глюкозу й галактозу. Дикий штам Е. coli зазвичай росте на глюкозі й містить до 10 молекул цих ферментів на клітину. Якщо замість глюкози в середовище додати лактозу (нове джерело енергії та вуглецю), то штам не ростиме, поки не буде синтезовано відповідні ферменти (адаптивний синтез). Кількість кожного з трьох ферментів має підвищитись до 5000. При надходженні в клітину лактози (індуктора) її молекули зв'язуються з білком-репресором і блокують зв'язок між репресором і геном- оператором. Ген-оператор і структурні гени при цьому починають знову функціонувати й синтезувати необхідну мРНК, що "дає команду» рибосомам синтезувати β-галактозидазу. Одночасно ген-регулятор продовжує стимулювати утворення репресора, але останній блокується новими молекулами лактози, тому синтез ферменту β-галактозидази триває. Як тільки молекули лактози повністю розщепляться, репресор звільняється і, надійшовши до ДНК, зв'язує ген-оператор та блокує синтез мРНК, а отже, і синтез β-галактозидази на рибосомах.
Таким чином, біосинтез мРНК, що контролює синтез білка в рибосомах, залежить від функціонального стану репресора тетрамерного білка із загальною молекулярною масою 1,5·105. Якщо він перебуває в активному стані, тобто не зв'язаний з індуктором, то блокує ген-оператор і синтез мРНК не відбувається. При надходженні індуктора в клітину його молекули зв'язують репресор, перетворюючи останній у неактивну форму (або, можливо, знижують його спорідненість до гена-оператора). Структурні гени виходять з-під заборонного контролю й починають синтезувати потрібну мРНК.
Як було відмічено, концентрація ряду ферментів у клітинах різко знижується при підвищенні вмісту кінцевих продуктів, що утворюються в ланцюзі послідовних ферментативних реакцій. Такий ефект, який назвали репресією ферментів, часто спостерігається в реакціях біосинтезу. У цих випадках молекули репресора, що також утворюються за "командою" гена-регулятора, є неактивними й не здатні інгібувати функціонування гена- оператора, а отже, і всього оперона, однак набувають такої здатності після утворення комплексу з кінцевим або одним із кінцевих продуктів біосинтетичного процесу (рис. 6.48). Кінцевий продукт виступає, таким чином, як корепресор. Ці дані були отримані при дослідженні триптофанового й гістидинового оперонів.
Якщо клітини E. coli ростуть на середовищі, що містить як джерело азоту солі амонію, вони змушені синтезувати всі азотовмісні речовини й мають усі ферменти для синтезу 20 амінокислот. При додаванні в середовище однієї з амінокислот (триптофан або гістидин) клітина припиняє синтез усього набору ферментів, необхідних для утворення цих амінокислот. Спостерігається репресія кінцевим продуктом (триптофаном або гістидином) синтезу ферментів, що каталізують послідовні реакції відповідного метаболічного шляху. Регуляція роботи his- і trp-оперона відбувається таким чином: за відсутності в середовищі гістидину або триптофану регуляторний білок-репресор не має спорідненості до оператора і здійснюється синтез ферментів, що каталізують утворення цих амінокислот. При додаванні, наприклад, гістидину (корепресора) відбуваються конформаційні зміни в молекулі білка-репресора, що його приєднав, з подальшим підвищенням спорідненості всього комплексу (білок-репресор-корепресор) до оператора. Це приводить до зупинки транскрипції оперона.
Є дані про те, що як корепресори в синтезі ферментів обміну амінокислот, очевидно, можуть виступати не тільки вільні амінокислоти як кінцевий продукт біосинтетичної реакції, а й аміноацил-тРНК.
У регуляції експресії структурних генів специфічна участь належить CRP білкам (від англ. cAMP receptor protein), які також називаються САР (від англ. catabolic gene activatorprotein). Після їх взаємодії з цАМФ утворюється комплекс, який сприяє приєднанню РНК- полімерази до промоторної ділянки й початку транскрипції оперона. Таким чином, CRP-цАМФ є додатковим регулятором синтетичних процесів у клітині. Оперони зі спільними регуляторами називаються регулонами. До складу прокаріотичних регулонів входять також гени білків теплового шоку та гени SOS відповіді на пошкодження ДНК. Отже, репресія та індукція синтезу білків у прокаріотів сприяють адаптаційному процесу до нових умов середовища.
Регуляція біосинтезу білків в еукаріотів має складніший характер. Процеси транскрипції та трансляції в них розділені як у просторі (наявність ядерної мембрани), так і в часі, що має принципове значення для функціонування регуляторних систем. До характерних особливостей еукаріотичних клітин можна додати також структурованість генетичного матеріалу: ДНК входить до складу хроматину (тісний контакт з гістонами й негістоновими білками), який для ініціації транскрипції має пройти етап складних змін структури транскрибуючих областей; переривчастість генів, що зумовлює сплайсинг РНК. Хоча стадія ініціації транскрипції, як і інші складні етапи цього процесу, є досить важливим пунктом регуляції біосинтезу білка, проте принциповішими є посттранскрипційні процеси - на рівні процесингу, транспорту та трансляції.
На рівні трансляції можна виділити три основні способи регуляції. Перший - позитивна регуляція на основі спорідненості мРНК до ініціаторного рибосомного комплексу і факторів ініціації (дискримінація мРНК). Другий - негативна регуляція за допомогою білків-репресорів, які, зв'язуючись із мРНК, блокують ініціацію (трансляційна репресія). Цими двома способами регулюються індивідуальні мРНК, тобто трансляція кожної мРНК може специфічно контролюватись незалежно від інших мРНК клітини. Третій спосіб - це тотальна регуляція трансляції всієї сукупності мРНК клітини за допомогою модифікації факторів ініціації.
Швидкість або частота ініціації трансляції рибосомами може розрізнятися для різних мРНК. В еукаріотичних клітинах дискримінація мРНК зумовлена різною спорідненістю факторів ініціації, а не самих рибосом, до різних 5'-кінцевих ініціаторних структур
мРНК. Фактори ініціації локалізуються на малих рибосомних суб- одиницях, що й визначає різну ефективність посадки рибосом на різні мРНК і, відповідно, дискримінацію на сильні та слабкі. Різна "сила" мРНК значною мірою визначає співвідношення продукції різноманітних білків у клітині. Так, структурні білки мембран, рибосомні білки, фактори елонгації, білки оболонки вірусів та інші білки, необхідні у великій кількості, кодуються сильними мРНК, а багато спеціалізованих ферментів і регуляторних білків - слабкими мРНК. Отже, дискримінацію мРНК можна розглядати як механізм конститутивного контролю фіксованого співвідношення продуктів білкового синтезу.
Типовий механізм трансляційної репресії полягає в тому, що спеціальний білок, так званий репресор, специфічно взаємодіє з тією областю мРНК, яка відповідає за зв'язування рибосомної суб- одиниці при ініціації трансляції. Білок-репресор заважає зв'язуванню ініціаторного рибосомного комплексу й тим самим або зменшує швидкість ініціації, або повністю блокує її.
Крім типової трансляційної репресії еукаріоти виробили цікавий механізм маскування мРНК, коли відповідна мРНК стає недоступною не тільки для ініціації трансляції, а й фактично виведена з усіх інших процесів - деградації нуклеазами, ферментативної модифікації її 3'-кінця шляхом поліаденілювання. Маскування здійснюється білками й залежить від зовнішніх сигналів (ефекторів). Маскування й демаскування мРНК є особливо характерними для процесів гаметогенезу (оогенезу й сперматогенезу), раннього ембріонального розвитку, клітинного диференціювання, гормональної регуляції.
Найбільш вивчений шлях тотальної регуляції білкового синтезу в еукаріотів - це активація протеїнкіназ, які фосфорилюють фактор ініціації еІР-2, що призводить до пригнічення ініціації трансляції всіх мРНК клітини. Сигналами для їх активації в клітині є тепловий шок та інші види стресових впливів, нестача ростових факторів, амінокислотне голодування, нестача заліза, вірусні інфекції. Ступінь пригнічення білкового синтезу може варіювати залежно від рівня стресу. Отже, численні та взаємопов'язані шляхи регуляції трансляції спрямовані на координування всіх ланок процесу й регулювання швидкості синтезу білка.