БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.3. Кофактори й коферменти
7.3.3.Мультисубстратні реакції
Більшість ферментів каталізує реакції, в яких бере участь більш ніж один субстрат. У разі, якщо кофермент не є простетичною групою, його також можна розглядати як ще один субстрат. Отже, учасників ферментативної реакції може бути декілька: безпосередньо фермент, кілька субстратів і кофермент. У таких випадках механізм ферментативної реакції, як правило, може відбуватися одним із двох шляхів: за механізмом "пінг-понг" (механізм подвійного заміщення) або послідовним. Розглянемо їх обидва. Схематично механізм "пінг-понг" можна зобразити наступним чином:
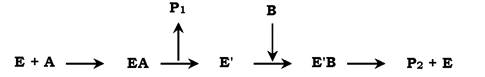
Субстрат А, взаємодіючи з ферментом (Е), перетворюється на продукт (Рі). У результаті перетворення фермент залишається не в нативній формі, а в зміненій (Е') унаслідок модифікації коферменту. Далі до активного центру Е' приєднується субстрат В, який перетворюється на продукт (Р2) з вивільненням нативної форми ферменту Е.
Хороший приклад механізму "пінг-понг" - це реакції трансамінування за участю ферментів амінотрансфераз (кофермент - піридоксальфосфат). Амінотрансферази, відкриті радянським ученим А.Е. Браунштейном, каталізують оборотні реакції перенесення аміногрупи з амінокислоти на кетокислоту. Механізм "пінг-понг" такої реакції схематично зображено на рис. 7.7.
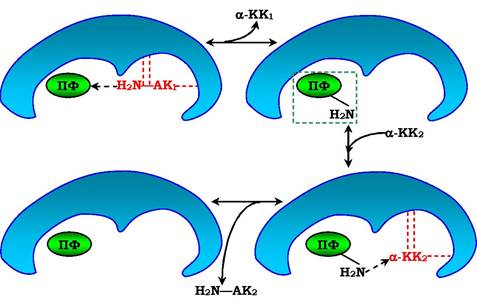
Рис. 7.7. Події в активному центрі амінотрансферази як приклад механізму "пінг-понг":
кофермент піридоксальфосфат (ПФ), зв'язаний з ферментом, бере а-аміногрупу від першої амінокислоти (АК1), яка при цьому перетворюється в а-кетокислоту 1 (КК1) і вивільнюється з активного центру ферменту.
Далі до активного центру ферменту приєднується а-кетокислота 2 (КК2), яка забирає аміногрупу від коферменту й перетворюється в α-амінокислоту (АК2)
Інший приклад механізму "пінг-понг" - реакції дегідрування за участю коферменту ФАД (флавінаденіндинуклеотид) або FMN (флавінмононуклеотид), які міцно зв'язані з ферментом і, відповідно, не можуть розглядатися як другий субстрат. Схематично структуру цих коферментів і відповідні їм хімічні формули наведено на рис. 7.8.
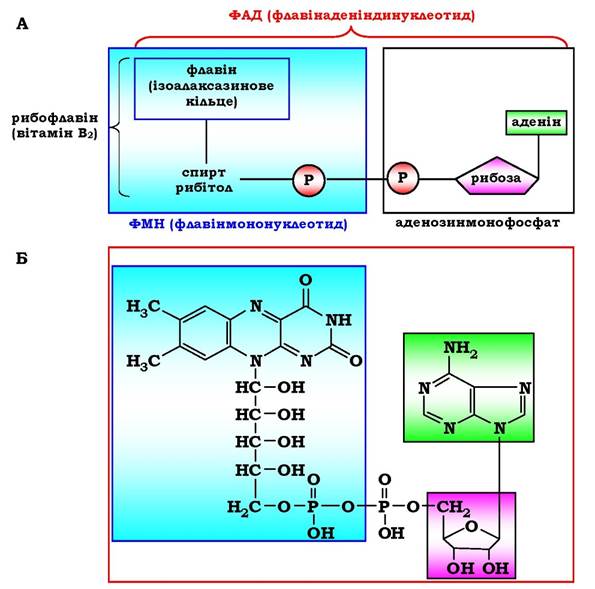
Рис. 7.8.Структура (А) і хімічна будова (Б) коферментів ФМН і ФАД
ФМН і ФАД беруть участь в окисно-відновних реакціях, акцентуючи 2 е- і 2 Н+ в ізоалаксазинове кільце.
Схему реакції дегідрування (як приклад механізму "пінг-понг" за участю коферментів ФАД і ФМН) можна зобразити наступним чином:
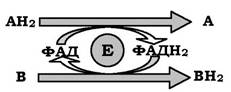
де АН2 - донор водню, який окиснює субстрат 1; А - окиснена форма субстрату 1; В - акцептор водню - субстрат 2; ВН2 - відновлена форма субстрату 2, (ФАД), (ФАДН2) - окиснена й відновлена форми коферменту ФАД, що входить до складу ферменту Е.
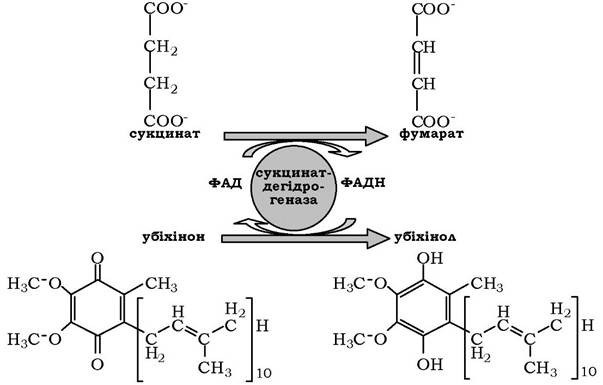
Як приклад ФАД-залежної реакції можна навести сукцинатдегідрогеназну реакцію. У цій реакції другим субстратом є убіхінон - один із посередників у дихальному ланцюзі:
У випадку послідовного механізму для перебігу ферментної реакції потрібна одночасна взаємодія двох субстратів. У такому разі можливе приєднання субстратів двома різними шляхами, це:
✵ механізм упорядкованої взаємодії субстрату з активним центром ферменту:
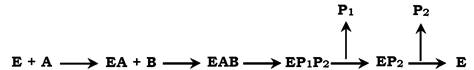
Першим до активного центру ферменту приєднується субстрат А, полегшуючи приєднання субстрату В. Після хімічної модифікації також спостерігають певний порядок вивільнення продуктів реакції;
✵ механізм випадкової взаємодії субстрату з активним центром ферменту:
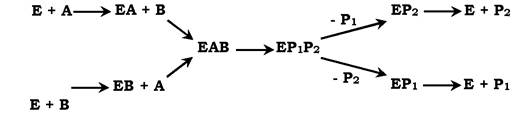
Пріоритетності у взаємодії субстратів А і В з активним центром ферменту немає (у кожного субстрату є свій центр зв'язування в активному центрі). Також немає чіткої закономірності у вивільненні продуктів реакції.
Прикладом послідовного впорядкованого механізму може бути реакція дегідрування за участю коферментів НАД+, НАДФ+. Схематично структуру та хімічні формули цих коферментів наведено на рис. 7.9. Обидва коферменти функціонують як посередники в перенесенні двох електронів і одного протона від донора до акцептора, а другого протона - у середовище:
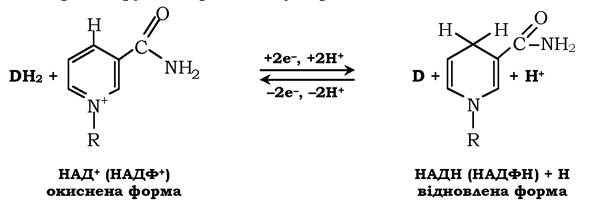
Донор і акцептор не обов'язково беруть участь в одному метаболічному шляху. Іншими словами, відновлена форма цих нуклеотидів діє як загальний пул електронів, утворений у результаті окисних реакцій, і може бути використана в різних відновних реакціях. Такі реакції називають спряженими:
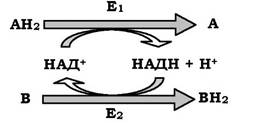
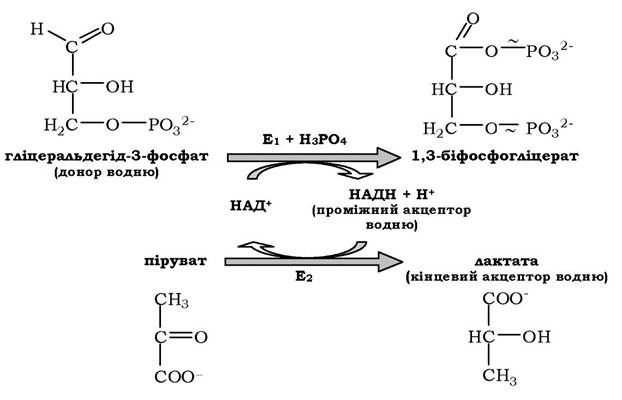
де АН2 - донор водню, відновлена форма субстрату 1; А - окиснена форма субстрату 1; В - акцептор водню - другий субстрат; ВН2 - відновлена форма субстрату 2; НАД+, НДДН - окиснена й відновлена форми коферменту; Е1 і Е2 - ферменти.
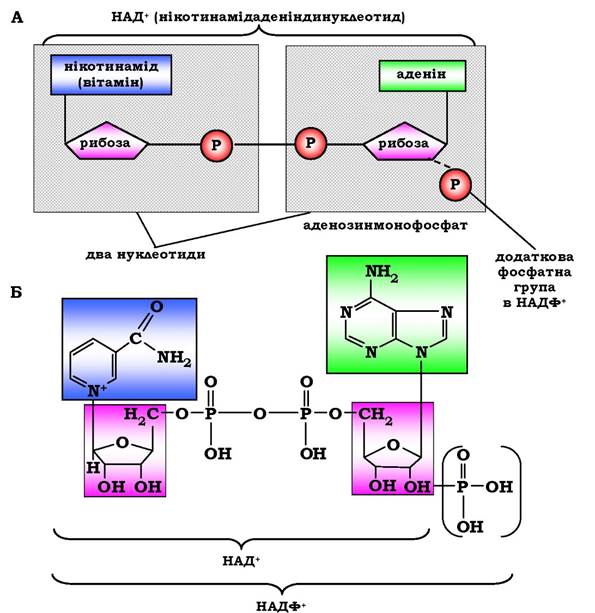
Рис. 7.9. Структура (А) і хімічна будова (Б) коферментів НАД+ і НАДФ+
Дві ферментативні реакції, які каталізуються ферментами Е1 і Е2, спряжені одна з одною за допомогою НАД+, що слугує субстратом у кожному з цих випадків. Для першого ферменту субстратом є окиснена форма НАД+, як другий субстрат виступає донор водню (приклад послідовних реакцій), а продуктом є відновлена форма НАД; для Е2 - навпаки. Як приклад можна розглянути наступні спряжені реакції, де Е1 - гліцеральдегідфосфатдегідрогеназа, Е2 - лактатдегідрогеназа: