БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.5.Основи кінетики ферментативних реакцій
7.5.1.Залежність швидкості ферментативної реакції від концентрації ферментів
При проведенні ферментативної реакції в умовах надлишку субстрату швидкість реакції буде залежати від концентрації ферменту. Графічна залежність такої реакції має вигляд прямої лінії (рис. 7.16).
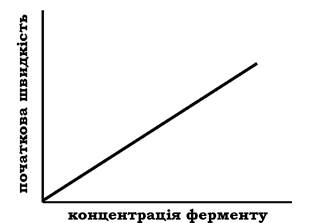
Рис. 7.16. Залежність швидкості ферментативної реакції від концентрації ферменту
Проте кількість ферменту часто неможливо визначити в абсолютних величинах, тому на практиці використовують умовні величини, які характеризують активність ферменту: одна міжнародна одиниця активності (МО) відповідає такій кількості ферменту, яка каталізує перетворення 1 мкмоль субстрату за 1 хв за оптимальних умов проведення ферментативної реакції. Оптимальні умови індивідуальні для кожного ферменту й залежать від температури середовища, рН розчину за відсутності активаторів та інгібіторів:
![]()
Кількість одиниць активності (пМО) визначають за формулою
МО _ кількість перетвореного субстрату (мкмоль)
час (хв)
У 1973 р. було прийнято нову одиницю активності ферментів: 1 катал (кат), що відповідає такій кількості каталізатора, яка перетворює 1 моль субстрату за 1 с. Кількість каталів визначають за формулою
![]()
Міжнародна одиниця ферментативної активності МО пов'язана з каталом наступними рівностями:
1 кат = 1 моль S/с = 60 моль S/хв = 60·106 мкмоль/хв = 6·107 МО,
1 МО = 1 мкмоль/хв = 1/60 мкмоль/с = 1/60 мк кат = 16,67 нкат.
У медичній і фармацевтичній практиці для оцінки активності ферментів часто використовують міжнародні одиниці активності - МО. Для оцінки кількості молекул ферменту серед інших білків даної тканини визначають питому активність (ПА) ферменту, що чисельно дорівнює кількості одиниць активності ферменту (nМО) у зразку тканини на масу [мг] білка в цій тканині:
![]()
За питомою активністю оцінюють очищення ферменту: чим менше сторонніх білків, тим вища питома активність.