БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.5.Основи кінетики ферментативних реакцій
7.5.4.Залежність швидкості ферментативної реакції від кількості субстрату
Якщо концентрацію ферментів залишити постійною, змінюючи тільки кількість субстрату, то графік швидкості ферментативної реакції описують гіперболою (рис. 7.19).
При збільшенні кількості субстрату початкова швидкість зростає. Коли фермент стає повністю насиченим субстратом, тобто відбувається максимально можливе за даної концентрації ферменту формування ферментосубстратного комплексу, спостерігають найбільшу швидкість утворення продукту. Подальше підвищення концентрації субстрату не зумовлює збільшення утворення продукту, тобто швидкість реакції не зростає. Цей стан відповідає максимальній швидкості реакції Vmax. Отже, концентрація ферменту є лімітуючим фактором в утворенні продукту. Це спостереження стало основою ферментативної кінетики, розробленої вченими Л. Міхаелісом і М. Ментен у 1913 р.
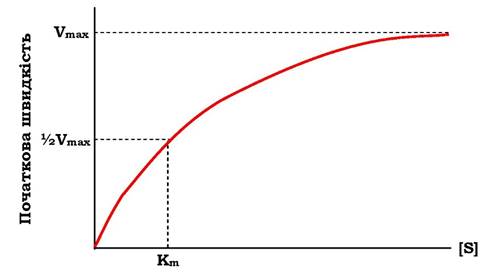
Рис. 7.19. Залежність швидкості реакції від концентрації субстрату (S).
Vmax - максимальна швидкість реакції за даної концентрації ферменту в оптимальних умовах проведення реакції; Km - константа Міхаеліса
Ферментний процес можна виразити таким рівнянням:
![]()
де k1 - константа швидкості утворення ферментосубстратного комплексу; k-1- константа швидкості зворотної реакції, розпаду ферментосубстратного комплексу; k2 - константа швидкості утворення продукту реакції.
Наступне співвідношення констант швидкостей (k-1+ k2)/k1 називають константою Міхаеліса й позначають Km. Швидкість реакції пропорційна концентрації ферментосубстратного комплексу ES, а швидкість утворення ES залежить від концентрації субстрату й концентрації вільного ферменту. На концентрацію ES впливає швидкість формування і розпаду ES. Найбільша швидкість реакції спостерігається в тому випадку, коли всі молекули ферменту перебувають у комплексі із субстратом, тобто ферментосубстратному комплексі ES, тобто [E] = [ES]. Залежність швидкості ферментативної реакції від концентрації субстрату виражається наступним рівнянням (математичне виведення цієї формули можна знайти в посібниках з ферментативної кінетики):
![]()
Це рівняння отримало назву рівняння Міхаеліса - Ментен.
Якщо швидкість реакції дорівнює половині максимальної, Km = [S] (рис. 7.19). Таким чином, константа Міхаеліса чисельно дорівнює концентрації субстрату, за якої досягається половина максимальної швидкості. Рівняння Міхаеліса - Ментен є основним рівнянням ферментативної кінетики, що описує залежність швидкості ферментативної реакції від концентрації субстрату.
Якщо концентрація субстрату значно більша Km (S >> Km), то збільшення концентрації субстрату на величину Km практично не впливає на суму (Km + S), її можна вважати рівною концентрації субстрату. Відповідно, швидкість реакції стає рівною максимальній швидкості: V = Vmax. За цих умов реакція має нульовий порядок, тобто не залежить від концентрації субстрату. Можна зробити висновок, що Vmax - величина постійна для даної концентрації ферменту й не залежить від концентрації субстрату.
Якщо концентрація субстрату значно менша за Km (S << Km), то сума (Km + S) приблизно дорівнює Km, відповідно, V = Vmax[S]/Km, тобто в даному випадку швидкість реакції прямо пропорційна концентрації субстрату (реакція має перший порядок).
Vmax і Km - кінетичні характеристики ефективності дії ферменту.
Vmax - характеристика каталітичної активності ферменту й має розмірність швидкості ферментативної реакції моль/ л, тобто визначає максимальну можливість утворення продукту за даної концентрації ферменту й за умов надлишку субстрату.
Km характеризує спорідненість даного ферменту до даного субстрату і є величиною постійною, яка не залежить від концентрації ферменту. Чим менша Km, тим більшою є спорідненість ферменту до даного субстрату, тим вища початкова швидкість реакції і навпаки, чим більша Km, тим менша початкова швидкість реакції, тим менша спорідненість ферменту до субстрату.
На рис. 7.20 показано залежність швидкості двох ферментативних реакцій (1 і 2) від концентрації субстрату. Константа Міхаеліса першого ферменту менша константи Міхаеліса другого ферменту (Km1 < Km2). Отже, спорідненість першого ферменту до субстрату є вищою, ніж у другого, і початкова швидкість реакції, що каталізується першим ферментом, вища порівняно з другим ферментом.
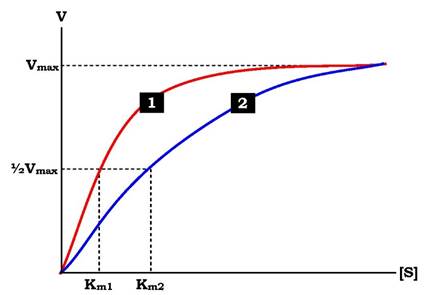
Рис. 7.20. Вплив різних концентрацій субстрату на швидкість реакції, що каталізується ферментами 1 і 2