БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.6.Інгібування ферментативної активності
7.6.2.Необоротне інгібування
Необоротне інгібування спостерігають при утворенні ковалентних стабільних зв'язків між молекулою інгібітору та ферменту. Найчастіше модифікації зазнає активний центр ферменту. У результаті фермент не може виконувати каталітичну функцію.
До необоротних інгібіторів належать іони важких металів, наприклад ртуті (Hg2+), срібла (Ag2+) і миш'яку (As3+), які в маленьких концентраціях блокують сульфгідрильні групи активного центру. Субстрат при цьому не може піддаватися хімічному перетворенню (рис. 7.26). За наявності реактиваторів ферментативна функція відновлюється. У великих концентраціях іони важких металів викликають денатурацію білкової молекули ферменту, тобто приводять до повної інактивації ферменту.
Специфічні й неспецифічні інгібітори. Для з'ясування механізму дії ферментів вельми цікавим є використання необоротних інгібіторів. З цією метою використовують речовини, які блокують певні групи активного центру ферменту. Такі інгібітори називають специфічними. Ряд сполук легко вступає в реакції з певними хімічними групами. Якщо ці групи беруть участь у каталізі, то відбувається інактивація ферменту.
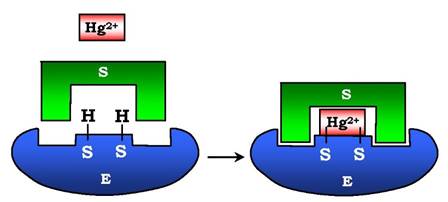
Рис. 7.26. Механізм дії іонів ртуті як необоротного інгібітору:
іони ртуті в малих концентраціях блокують сульфгідрильні групи активного центру, що приводить до зниження швидкості ферментативної реакції
Роль гідроксильних груп серину в механізмі каталізу досліджують за допомогою фторофосфатів, наприклад діізопропілфторофосфату (ДФФ), який специфічно реагує лише з одним із багатьох залишків серину в активному центрі ферменту. Залишок Сер, що здатний реагувати з ДФФ, має ідентичне або дуже схоже амінокислотне оточення (табл. 7.2). Його висока реакційна здатність порівняно з іншими залишками Сер зумовлена амінокислотними залишками, що також входять до активного центру ферменту.
Таблиця 7.2
Дослідження послідовності амінокислотних залишків навколо реакційноздатного залишку серину, що взаємодіє з ДФФ
Фермент |
Функція ферментів |
Амінокислотні залишки, що перебувають в оточенні реакційноздатного серину в активному центрі |
Хімотрипсин |
Асп Сер Глу |
|
Трипсин |
Протеолітичні |
Асп Сер Глу |
Тромбін |
ферменти |
Асп Сер Глу |
Еластаза |
Асп Сер Глу |
|
Холінестераза |
Естерази (гідроліз |
Глу Сер Ала |
Лужна фосфатаза |
ефірного зв'язку) |
Глу Сер Ала |
ДФФ належить до специфічних необоротних інгібіторів "серино- вих" протеолітичних ферментів, оскільки він утворює ковалентний зв'язок із гідроксильною групою серину, який міститься в активному центрі й відіграє ключову роль у процесі каталізу (рис. 7.27).
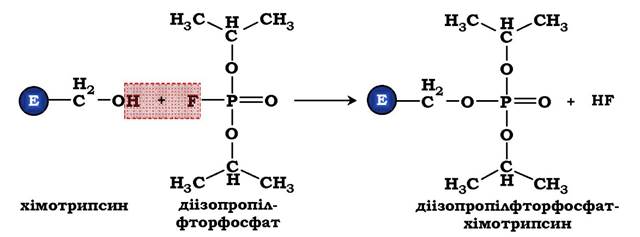
Рис. 7.27. Інгібування активності хімотрипсину за допомогою діізопропілфторофосфату
Монойодоцтова кислота, парахлормеркурібензоат легко вступають у реакції з SH-групами залишків цистеїну білків (рис. 7.28). Ці інгібітори не належать до специфічних, тому що вони реагують з будь-якими вільними SH-групами білків, їх називають неспецифічними інгібіторами. Якщо SH-групи беруть участь безпосередньо в каталізі, то за допомогою цих інгібіторів можливим є визначення ролі SH-груп ферменту в каталізі.
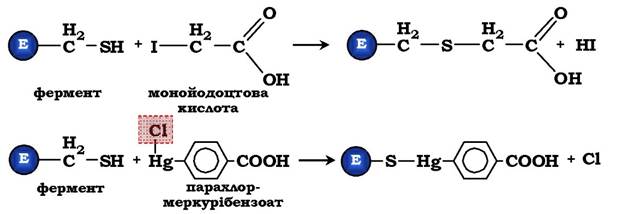
Рис. 7.28. Інгібування активності ферментів унаслідок ковалентної модифікації залишків цистеїну
Приклад лікарського препарату, дія якого заснована на необоротному інгібуванні ферментів, - широко використовуваний препарат аспірин. Протизапальний нестероїдний препарат аспірин забезпечує фармакологічну дію за рахунок інгібування ферменту циклооксигенази, що каталізує реакцію утворення простагландинів з арахідонової кислоти. У результаті хімічної реакції ацетильний залишок аспірину приєднується до вільної кінцевої ОН-групи серину циклооксигенази:
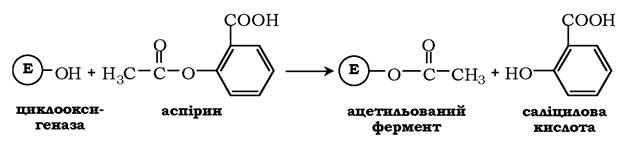
Це викликає зниження утворення продуктів реакції простагландинів із широким спектром біологічних функцій, зокрема є медіаторами запалення.