БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.7. Регуляція метаболічних процесів
7.7.3.Основні способи регуляції каталітичної активності ферментів
Алостерична регуляція. Алостеричними називають ферменти, активність яких регулюються не тільки кількістю молекул субстрату, але й іншими речовинами - ефекторами. Ті ефектори, котрі беруть участь в алостеричній регуляції, є клітинними метаболітами часто саме того шляху, регуляцію якого вони здійснюють.
Алостеричні ферменти відіграють важливу роль у метаболізмі, оскільки вони надзвичайно швидко реагують на найменші зміни внутрішнього стану клітини. Алостерична регуляція має велике значення за таких ситуацій:
✵ під час анаболічних процесів. Інгібування кінцевим продуктом метаболічного шляху й активація початковими метаболітами дозволяють здійснювати регуляцію синтезу цих сполук;
✵ під час катаболічних процесів. У разі накопичення АТФ у клітині відбувається інгібування метаболічних шляхів, що забезпечують отримання енергії. Субстрати при цьому використовуються на реакції резервування поживних речовин;
✵ для координації анаболічних та катаболічних шляхів. АТФ і АДФ - алостеричні ефектори, що діють як антагоністи;
✵ для координації паралельних і взаємопов'язаних метаболічних шляхів (наприклад, синтез пуринових і піримідинових нуклео- тидів, які використовуються для синтезу нуклеїнових кислот). Таким чином, кінцеві продукти одного метаболічного шляху можуть бути алостеричними ефекторами іншого такого шляху.
Ефектор, який викликає зниження (інгібування) активності ферменту, називають негативним ефектором, або інгібітором. А той, що зумовлює підвищення (активацію) активності ферментів - позитивним ефектором, або активатором.
Алостеричними ефекторами найчастіше виступають різноманітні метаболіти. Кінцеві продукти метаболічного шляху часто є інгібіторами алостеричних ферментів, а вихідні речовини - активаторами. Це так звана гетеротропна регуляція. Такий вид алостеричної регуляції дуже поширений у біологічних системах.
Рідше зустрічається випадок алостеричної регуляції, коли сам субстрат може виступати як позитивний ефектор. Така регуляція називається гомотропною (ефектор і субстрат - одна й та сама речовина). Такі ферменти мають кілька центрів зв'язування субстрату, які можуть виконувати подвійну функцію: каталітичну й регуляторну. Алостеричні ферменти такого типу використовуються в тому разі, коли субстрат накопичується в надлишку й має бути швидко перетворений на продукт.
Виявити ферменти з алостеричною регуляцією можна, вивчаючи їхню кінетику. Ці ферменти не підпорядковуються законам Міхаеліса - Ментен, вони мають характерну S-подібну криву залежності швидкості реакції від концентрації субстрату.
Особливості будови та функціонування алостеричних ферментів:
✵ зазвичай це олігомерні білки, які складаються з декількох протомерів або мають доменну будову;
✵ вони мають алостеричний центр, просторово віддалений від каталітично активного центру;
✵ ефектори приєднуються до ферменту нековалентно в алостеричних (регуляторних) центрах;
✵ алостеричні центри, як і каталітичні, можуть виявляти різну специфічність до лігандів: вона може бути абсолютною і груповою. Деякі ферменти мають кілька алостеричних центрів, одні з яких специфічні до активаторів, а інші - до інгібіторів;
✵ протомер, на якому розташований алостеричний центр, є регуляторним, на відміну від каталітичного протомера, що містить активний центр, в якому відбувається хімічна реакція;
✵ алостеричні ферменти мають властивість кооперативності: взаємодія алостеричного ефектора з алостеричним центром викликає послідовну кооперативну зміну конформації всіх субодиниць, що призводить до зміни конформації активного центру та зміни спорідненості ферменту до субстрату, що збільшує або зменшує каталітичну активність ферменту (рис. 7.30);
✵ регуляція алостеричних ферментів є оборотною: від'єднання ефектора від регуляторної субодиниці відновлює вихідну каталітичну активність ферменту;
✵ алостеричні ферменти каталізують ключові реакції даного метаболічного шляху.
Швидкість метаболічних процесів залежить від концентрації речовин, що використовуються та утворюються в даному ланцюзі реакцій. Така регуляція є логічною, оскільки під час накопичення кінцевого продукту він (продукт) може діяти як алосте- ричний інгібітор ферменту, який каталізує найчастіше початковий етап даного метаболічного шляху:
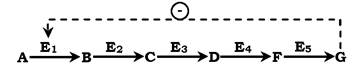
Фермент, що каталізує перетворення субстрату А на продукт В, має алостеричний центр для негативного ефектора, яким є кінцевий продукт метаболізму G. Якщо концентрація Gзбільшується (тобто речовина G синтезується швидше, ніж використовується), інгібується активність одного з початкових ферментів. Таку регуляцію називають негативним зворотним зв'язком, або
ретроінгібуванням. Негативний зворотний зв'язок - поширений механізм регуляції метаболізму в клітині.
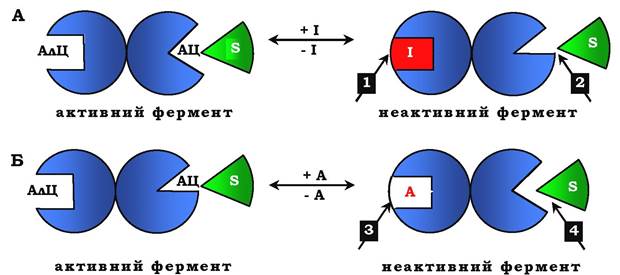
Рис. 7.30. Схема, що пояснює роботу алостеричного ферменту:
А - дія негативного ефектора (інгібітору); Б - дія позитивного ефектора (активатора); АлЦ - алостеричний центр; АЦ - активний центр (каталітичний); І - інгібітор; S - субстрат; А - активатор; 1 - приєднання інгібітору до алостеричного центру; 2 - зниження спорідненості активного центру до субстрату, зниження каталітичної активності; 3 - приєднання активатора до алостеричного центру; 4 - збільшення спорідненості до субстрату, підвищення каталітичної активності
У центральних метаболічних шляхах вихідні речовини можуть бути активаторами ключових ферментів метаболічного шляху. Як правило, при цьому алостеричній активації піддаються ферменти, що каталізують кінцеві реакції метаболічного шляху:
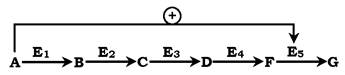
Як приклад розглянемо принцип регуляції гліколізу - специфічного (початкового) шляху розпаду глюкози (рис. 7.31). Одним із кінцевих продуктів її розпаду є молекула АТФ. При надлишку в клітині АТФ відбувається ретроінгібування алостеричних ферментів фосфофруктокінази і піруваткінази. Під час утворення великої кількості фруктозо-1,6-бісфосфату спостерігають алостеричну активацію ферменту піруваткінази. Завдяки такій регуляції здійснюється узгодженість проходження метаболічних шляхів розпаду глюкози.
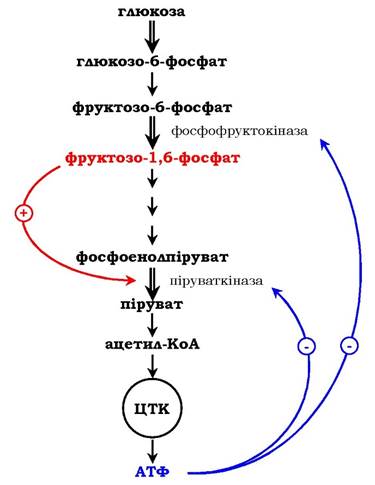
Рис. 7.31. Схема позитивної та негативної регуляції катаболізму глюкози:
Плюсами позначено активація, мінусами - інгібування ферментів
Регуляція за допомогою білок-білкових взаємодій. Деякі ферменти змінюють свою каталітичну активність у результаті даних взаємодій. Розглянемо два механізми активації ферментів за допомогою білок-білкових взаємодій:
✵ активація ферментів у результаті приєднання регуляторних білків;
✵ зміна каталітичної активності внаслідок асоціації або дисоціації протомерів ферменту.
Активація ферментів у результаті приєднання регуляторних білків. Цей тип регуляції розглянемо на прикладі активації ферменту аденілатциклази, локалізованої в плазматичній мембрані клітини.
Активний центр аденілатциклази локалізований на цитоплазматичній стороні плазматичної мембрани. Активована аденілатцикла- за каталізує реакцію утворення з АТФ циклічного 3',5'-АМФ (цАМФ) - вторинного, внутрішньоклітинного посередника дії гормонів:
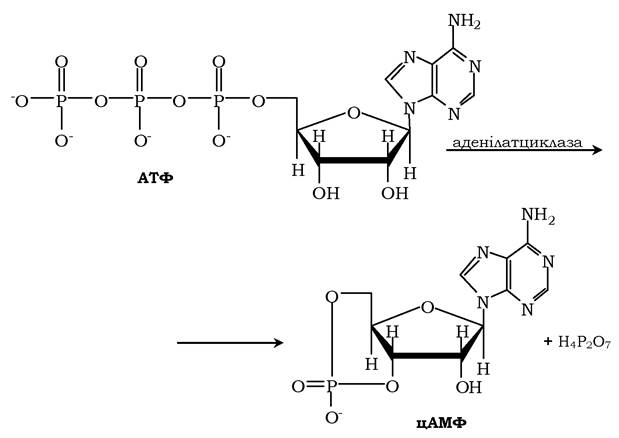
У мембрані аденілатциклаза функціонує в комплексі з іншими білками:
✵ як рецептор гормону, що виступає в позаклітинне середовище та взаємодіє з гормонами;
✵ з G-білком, який займає проміжне положення між рецептором і ферментом аденілатциклазою. G-білок - це оліго- мерний білок, який складається з трьох субодиниць - α, β, і γ. α-субодиниця має центр зв'язування й розщеплення ГТФ. Тому цей білок називається ГТФ-зв'язувальним білком, або G-білком;
✵ у результаті зв'язування гормону з рецептором відбувається зміна конформації G-білка, зменшення його спорідненості до молекули ГДФ, з якою він зв'язаний за відсутності гормонального сигналу, і збільшення спорідненості до ГТФ. Приєднання ГТФ викликає конформаційні зміни в G-білку й дисоціацію його на субодиниці: субодиницю α, зв'язану з ГТФ (α-ГТФ), і димер βγ;
✵ α-ГТФ має високу спорідненість до аденілатциклази, його приєднання викликає активацію останньої, тому α-ГТФ є регуляторним білком, а даний механізм активації аденілатцик- лази називають активацією ферментів у результаті приєднання регуляторних білків (рис. 7.32).
Регуляція каталітичної активності ферментів асоціацією/дисоціацією протомерів. Протеїнкінази - група ферментів, яка каталізує перенесення залишку фосфорної кислоти з АТФ на специфічні ОН-групи амінокислотних залишків білків (викликають фосфорилювання білків). Механізми активації різних протеїнкіназ не однакові. Як приклад регуляції каталітичної активності ферментів асоціацією або дисоціацією протомерів можна навести регуляцію активності ферменту протеїнкінази А.
Протеїнкіназа А (цАМФ-залежна) складається з чотирьох субодиниць двох типів: дві регуляторні (R) і дві каталітичні (С). Такий тетрамер не має каталітичної активності. Регуляторні субодиниці мають ділянки зв'язування для циклічного 3',5'-АМФ (цАМФ), по дві на кожну субодиницю. Приєднання чотирьох молекул цАМФ до двох регуляторних субодиниць зумовлює зміну конформації регуляторних протомерів і дисоціацію тетрамерного комплексу, при цьому вивільнюються дві активні каталітичні субодиниці (рис. 7.32). Такий механізм регуляції оборотний. Відщеплення молекул цАМФ від регуляторних субодиниць спричиняє асоціацію регуляторних і каталітичних субодиниць проте- їнкінази А з утворенням неактивного комплексу.
Регуляція каталітичної активності ферментів шляхом фосфорилювання / дефосфорилювання. У біологічних системах часто зустрічається механізм регуляції активності ферментів за допомогою ковалентної модифікації амінокислотних залишків. Швидкий і широко розповсюджений спосіб хімічної модифікації ферментів - фосфорилювання / дефосфорилювання. Модифікації піддаються ОН-групи ферменту. Фосфорилювання відбувається ферментами протеїнкіназами, а дефосфорилювання - фосфопротеїнфосфатазами. Приєднання залишку фосфорної кислоти приводить до зміни конформації активного центру та його каталітичної активності. При цьому результат може бути двояким: одні ферменти при фосфорилюванні активуються, інші, навпаки, стають менш активними (рис. 7.33).
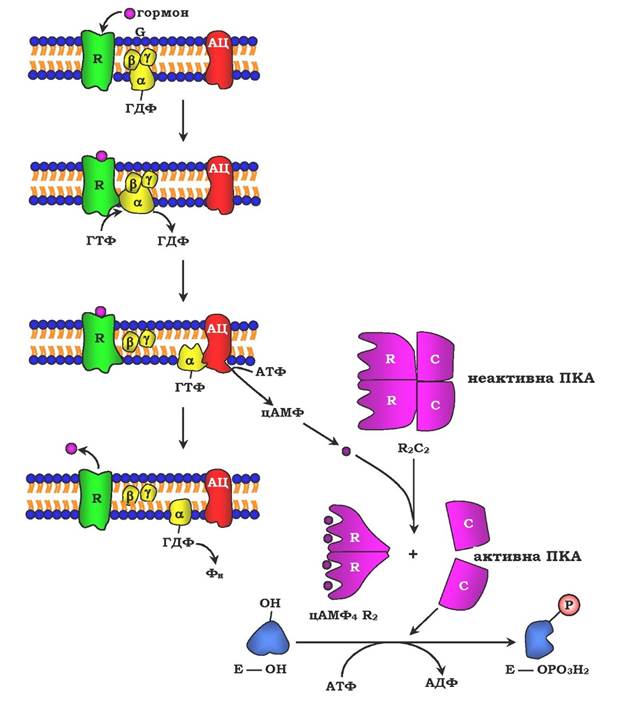
Рис. 7.32. Регуляція активності аденілатциклази:
гормон (Г), взаємодіючи з рецептором (R) на поверхні клітин, приводить до зменшення спорідненості ПФ-зв'язувального білка (G-білка, який складається з протомерів а, β, γ) до ГДФ і збільшення спорідненості до ГТФ. Приєднання молекули ГТФ до активного центру G-білка викликає дисоціацію комплексу на субодиниці а-ГТФ і димер βγ. Комплекс α-ГТФ активує аденілатциклазу, що сприяє синтезу із АТФ внутрішньоклітинних регуляторних молекул цАМФ. АЦ - аденілатциклаза, ПКА - протеїнкіназа А, Фн-Н3РО4
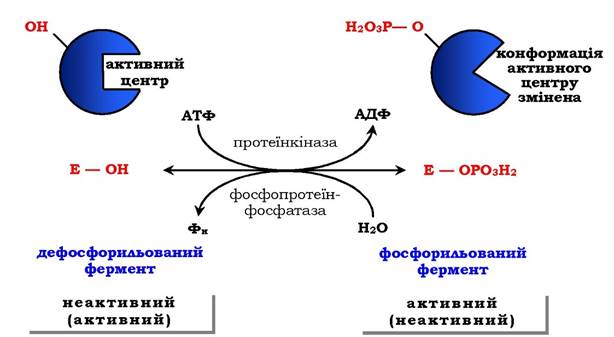
Рис. 7.33. Регуляція активності ферментів фосфорилюванням / дефосфорилюванням
Зміни активності ферменту, викликані фосфорилюванням, оборотні. Відщеплення залишку фосфорної кислоти здійснюється ферментами фосфопротеїнфосфатазами. Активність протеїнкіназ і фосфопротеїнфосфатаз регулюється гормонами, що дозволяє швидко змінювати активність ключових ферментів метаболічних шляхів залежно від умов зовнішнього середовища. Антагоністичні за функцією гормони протилежним чином впливають на фосфорилювання /дефосфорилювання ферментів, викликаючи протилежні ефекти змін метаболізму клітини. Наприклад, під дією глюкагону (у період між прийомами їжі) у клітинах відбувається зменшення синтезу енергетичного матеріалу - жиру, глікогену, і посилення його розпаду (мобілізація), викликаного фосфорилюванням ключових ферментів цих процесів. А під дією інсуліну (під час травлення), навпаки, активується синтез глікогену та інгібується його розпад, оскільки взаємодія інсуліну з рецептором активує сигнальний шлях, що викликає дефосфорилювання тих самих ключових ферментів.
Регуляція каталітичної активності ферментів частковим (обмеженим) протеолізом. Деякі ферменти, які функціонують поза клітинами (у ШКТ або плазмі крові), синтезуються у вигляді неактивних попередників і активуються лише внаслідок гідролізу одного чи декількох певних пептидних зв'язків, що спричиняє відщеплення частини білкової молекули попередника. У результаті в частині молекули, що залишилась, відбувається конфор- маційна перебудова та формується активний центр ферменту.
Розглянемо механізм часткового протеолізу на прикладі активації протеолітичного ферменту трипсину (рис. 7.34). Трипсиноген, який синтезується в підшлунковій залозі, під час травлення по протоках підшлункової залози потрапляє у дванадцятипалу кишку, де й активується шляхом часткового протеолізу під дією ферменту кишечнику ентеропептидази. У результаті відщеплення гексапептиду з N-кінця формується активний центр у вільній частині молекули. Потрібно нагадати, що трипсин відносять до родини "серинових протеаз» - активний центр ферменту містить функціонально важливий Сер.
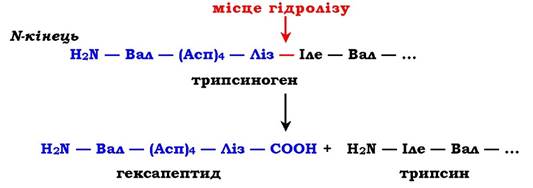
Рис. 7.34. Активація трипсину частковим протеолізом. Під дією ферменту кишечнику ентеропептидази відбувається гідроліз пептидного зв'язку Ліз—Іле. У результаті відщеплення гексапептиду з N-кінця формується активний центр у вільній частині молекули
Частковий протеоліз - приклад регуляції, унаслідок якої активність ферменту змінюється необоротно. Період функціонування таких ферментів, як правило, короткий, він визначається часом життя білкової молекули. Частковий протеоліз лежить в основі активації протеолітичних ферментів, білків системи згортання крові й фібринолізу, білків системи комплементу, а також пептидних гормонів.