БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 7. ЕНЗИМОЛОГІЯ
7.9. Використання ферментів у медицині
7.9.1.Ензимодіагностика
Ензимодіагностика полягає в постановці діагнозу захворювання (або синдрому) на базі визначення активності ферментів у біологічних рідинах людини. Принципи ензимодіагностики засновані на наступних положеннях:
✵ унаслідок пошкодження клітин у крові або інших біологічних рідинах (наприклад, у сечі) збільшується концентрація внутрішньоклітинних ферментів;
✵ кількість вивільненого ферменту є достатньою для його виявлення;
✵ активність ферментів у біологічних рідинах, які виявляють при пошкодженні клітин, є стабільною протягом досить довгого часу й відрізняється від нормальних значень;
✵ деякі ферменти мають переважну або абсолютну локалізацію в певних органах (органоспецифічність);
✵ існують відмінності у внутрішньоклітинній організації ряду ферментів.
Причини, що приводять до збільшення кількості ферментів у крові. Ферменти плазми крові можна розділити на дві групи. Перша, відносно невелика, група ферментів секретується в плазму крові певними органами. Скажімо, печінка синтезує неактивні попередники ферментів системи згортання крові. До другої відносять більшу групу ферментів, які вивільнюються з клітин під час їхнього нормального функціонування. Зазвичай ці ферменти виконують функції в середині клітини й не мають фізіологічного значення в плазмі крові. У здорової людини активність цих ферментів у плазмі низька й достатньо постійна, це забезпечується постійним співвідношенням швидкостей вивільнення їх із клітин і швидкостей їхнього руйнування.
При багатьох захворюваннях відбувається руйнування клітин, і їхній вміст, у тому числі й ферменти, виходять у кров. До причин, що викликають вивільнення внутрішньоклітинного вмісту в кров, належать порушення проникності мембран клітин (при запальних процесах) або порушення цілісності клітин (при некрозі). Визначення в крові активності ряду ферментів у біохімічних лабораторіях застосовують для діагностики захворювань серця, печінки, скелетної мускулатури та інших тканин. Рівень активності ферментів у плазмі корелює зі ступенем пошкодження клітин.
Для ензимодіагностики велике значення мають знання про субклітинну локалізацію ферментів. Так, поява в плазмі крові ферментів, що мають лише цитозольну локалізацію, свідчить про запальний процес; при знаходженні мітохондріальних або ядерних ферментів можна говорити про більш глибоке пошкодження клітини, скажімо, про некроз. Проте збільшення концентрації ферментів не завжди пов'язане з пошкодженням тканини. У разі надлишкової клітинної проліферації, наприклад, при онкопроліферативних процесах, збільшенні швидкості синтезу деяких ферментів у клітинах або при порушеному кліренсі (здатність виводитися нирками) спостерігається збільшення концентрації в крові певних ферментів. Нормальні значення активності ферментів у крові дітей і вагітних жінок відрізняються від показників, характерних для дорослих здорових людей.
Ізоферменти. Ферменти, що каталізують одну й ту саму хімічну реакцію, але які різняться первинною структурою білка, називають ізоферментами, або ізоензимами. Вони каталізують один і той же тип реакцій з принципово однаковим механізмом, але відрізняються один від одного кінетичними параметрами, умовами активації, особливостями зв'язку апоферменту та коферменту.
Природа появи ізоферментів різноманітна, однак найчастіше зумовлена відмінностями в структурі генів, які кодують ці ізоферменти. Відповідно, ізоферменти відрізняються за первинною структурою білкової молекули, і відповідно, за фізико-хімічними властивостями. На відмінностях у фізико-хімічних властивостях засновано методи визначення ізоферментів.
За своєю структурою ізоферменти в основному є олігомерними білками. Причому та чи інша тканина переважно синтезує визначені види протомерів. У результаті визначеної комбінації цих про- томерів формуються ферменти з різноманітною структурою - ізомерні форми. Виявлення певних ізомерних форм ферментів дозволяє використовувати їх для діагностики захворювань.
Ізоформи лактатдегідрогенази. Фермент лактатдегідрогеназа (ЛДГ) каталізує оборотну реакцію окиснення лактату (молочної кислоти) до пірувату (піровиноградної кислоти):

Лактатдегідрогеназа - олігомернии білок з молекулярною масою 144 000 Да, що складається з чотирьох субодиниць двох типів: М (від англ. muscle - м'яз) і Н (від англ. heart - серце). Комбінація цих субодиниць лежить в основі формування п'яти ізоформ лактатдегідрогенази (рис. 7.35, А). ЛДГ1 і ЛДГ2 найактивніші в серцевому м'язі та нирках, ЛДГ4 і ЛДГ5 - у скелетних м'язах і печінці. В інших тканинах є різні форми цього ферменту. Ізоформи ЛДГ різняться електрофоретичною рухливістю, що дозволяє встановлювати тканинну приналежність ізоформ ЛДГ (рис. 7.35, Б).
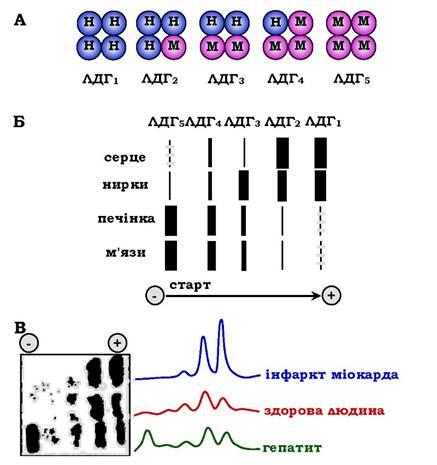
Рис. 7.35. Ізоформи лактатдегідрогенази:
А - будова різних ізоформ ЛДГ; Б - розподіл на електрофореграмі й відносні кількості ізоформ ЛДГ у різних органах;
В - вміст ізоформ ЛДГ у плазмі крові в нормі й при патології (електрофореграми - ліворуч, фотометричне сканування - праворуч)
Виникнення внаслідок еволюції різних форм ЛДГ зумовлене особливостями окисного метаболізму тканин. Ізоферменти ЛДГ4 та ЛДГ5 (М-типи ЛДГ) працюють ефективно в анаеробних умовах, ЛДГ1 і ЛДГ2 (Н-типи) - в аеробних, коли піруват швидко окиснюється до СО2 і Н2О, а не відновлюється до молочної кислоти.
При деяких захворюваннях досліджують активність ЛДГ у плазмі крові. У нормі активність ЛДГ становить 170-520 ОД/л. Підвищення активності спостерігають при гострих ураженнях серця, печінки, нирок, а також при мегалобластичних і гемолітичних анеміях. Проте це вказує на пошкодження лише однієї з перерахованих тканин.
Для формулювання діагнозу необхідне дослідження ізоформ ЛДГ у плазмі крові методом електрофорезу. На рис. 7.35, В показано електрофореграми плазми крові здорової людини, хворого на інфаркт міокарда та хворого на гепатит. Виявлення в плазмі крові тканиноспецифічних ізоформ ЛДГ використовують як діагностичний тест на пошкодження даної тканини.
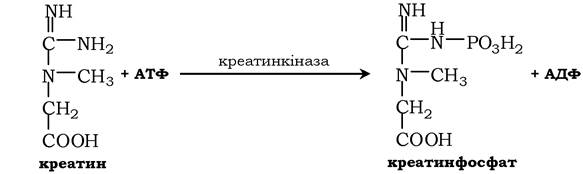
Ізоформи креатинкінази. Креатинкіназа (КК) каталізує реакцію утворення креатинфосфату:
Молекула КК - димер, що складається із субодиниць двох типів: М (від англ. muscle - м'яз) і В (від англ. brain - мозок). Із цих субодиниць утворюються три ізоферменти - ВВ, МВ, ММ. Ізофермент ВВ містяться переважно в головному мозку, ММ - у скелетних м'язах і МВ - у серцевому м'язі. Ізоформи КК мають різну електрофоретичну рухливість (рис. 7.36).
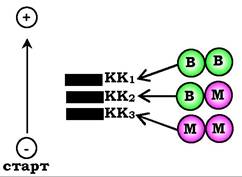
Рис. 7.36. Структура й електрофоретична рухливість різних ізоформ креатинкінази
Активність КК у нормі не повинна перевищувати 90 МО/л. Визначення активності КК у плазмі крові має діагностичне значення під час інфаркту міокарда (відбувається підвищення рівня МВ-ізоформи). Кількість ізоформи ММ може підвищуватися внаслідок травм і пошкоджень скелетних м'язів. Ізоформа ВВ не може проникати через гемоенцефалічний бар'єр, тому в крові практично не визначається навіть під час інсульту й діагностичного значення не має.
Ензимологія при інфаркті міокарда. Приблизно 30 % хворих на інфаркт міокарда мають атипову клінічну картину цього захворювання. Тому необхідно проводити додаткові дослідження для підтвердження пошкодження серцевого м'яза.
Під час інфаркту міокарда спостерігають достовірні зміни в крові активностей ферментів КК, ЛДГ і аспартатамінотрансфе- рази (АСТ), які залежать від часу, що пройшов від початку розвитку інфаркту, і від зони тканинного пошкодження. Типову криву зміни активності цих ферментів зображено на рис. 7.37. Після закупорення (оклюзії) коронарної судини в крові спочатку відмічають підвищення активності КК ізоформи МВ, але фермент швидко видаляється з кровотоку. Виявлення підвищеної активності КК у плазмі крові - основний ензимодіагностичний критерій інфаркту міокарда. Якщо в пацієнта із загрудинним болем не знайдено зміни в активності КК, діагноз інфаркт міокарда є малоймовірним.
Додатковим підтвердженням діагнозу інфаркт міокарда є виявлення активності ферментів АСТ і ЛДГ у крові хворих. Динаміку змін цих активностей також показано на рис. 7.37. Активність АСТ у нормі становить 5-40 МО / л. Під час інфаркту міокарда активність АСТ підвищується через 4-6 год; максимум активності спостерігають протягом 2-3 днів. Рівень ЛДГ також збільшується в плазмі крові через декілька годин після закупорювання кровоносної судини; максимум активності спостерігають на 3-4 день, потім настає поступова нормалізація активності. Рівень підвищення активності ЛДГ корелює з розмірами пошкодження серцевого м'яза.
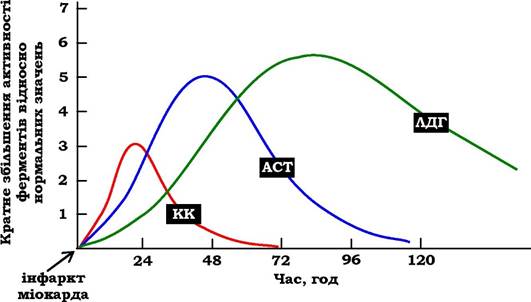
Рис. 7.37. Зміна активності ферментів у плазмі крові під час інфаркту міокарда