БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 8. ВІТАМІНИ
8.3.Водорозчинні вітаміни
8.3.2. Вітамін В2 — рибофлавін
Будова й фізико-хімічні властивості. Рибофлавін уперше був виділений із молока як термостабільний фактор у 1879 р. Потім подібні жовті сполуки були виділені з яєць, м'язів, і діставали назви відповідно до джерел виділення: лактофлавін, гепатофлавін, овофлавін тощо. Розчини рибофлавіну мають жовто-оранжеве забарвлення і здатні до флюоресценції. В основі молекули вітаміну лежить структура ізоалоксазину - гетероцикл, який є сполученням бензольного, піразинового та піримідинового кілець. Крім того, до складу вітаміну входить спирт рибіт. Рибофлавін погано розчиняється у воді при кімнатній температурі. При підкисленні середовища розчинність збільшується. Вітамін термостабільний - витримує нагрівання до 120°, але чутливий до дії світла.
Важливою властивістю рибофлавіну є його здатність до оборотного окиснення та відновлення (рис. 8.11). Відновлення рибофлавіну до дигідрорибофлавіну відбувається шляхом послідовного приєднання атомів водню в 1 та 5 положеннях з утворенням проміжного напіввідновленого семіхінонового радикала. Відновлена форма рибофлавіну може окиснюватися киснем повітря.
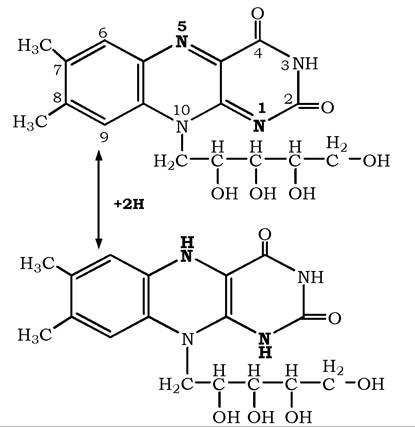
Рис. 8.11. Рибофлавін і дигідрорибофлавін
Біохімічні функції. Рибофлавін служить структурним елементом флавінмононуклеотиду (ФМН, FMN) і флавінаденіндинуклеотиду (ФАД, FAD), які є простетичними групами численних оксидоредуктаз (дегідрогеназ). Синтез ФМН відбувається у слизовій оболонці кишечнику шляхом фосфорилювання рибофлавіну за участю ферменту рибовлавінкінази, а ФАД синтезується з ФМН шляхом приєднання АМФ, донором якої є АТФ (рис. 8.12).
Флавінові нуклеотиди, як і вільний рибофлавін, можуть існувати в окисненій і відновленій формах.
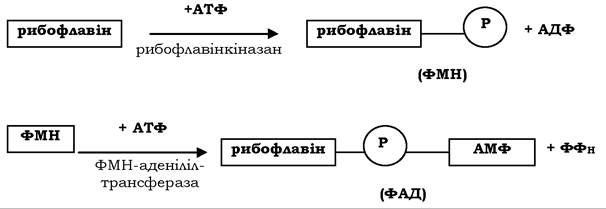
Рис. 8.12. Схема синтезу коферментів ФМН і ФАД
Флавінових дегідрогеназ відомо близько 200. Флавіновмісні ферменти можуть каталізувати реакції окиснення напівацеталів у лактони, спиртів - в альдегіди, амінів - в іміни, карбонільних сполук або карбонових кислот - у ненасичені карбонільні сполуки.
Флавінові нуклеотиди (рис. 8.13) є сильнішими окисниками, ніж нікотинамідні. Відновлені флавіни здатні окиснюватися киснем О2, що є характерним для небагатьох органічних сполук в організмі людини. Зазвичай флавінові нуклеотиди зв'язані з білками міцними ковалентними зв'язками.
Прикладом ферментів, що містять ФАД, є глюкозооксидаза. Вона каталізує окиснення глюкози до глюконової кислоти й використовується в медичній практиці для визначення глюкози в крові.
Дуже активними ферментами є оксидази амінокислот, які містяться зокрема у зміїних отрутах і каталізують окисне дезамінування амінокислот. До флавопротеїдів належить сукцинатдегідрогеназа, яка каталізує дегідрування сукцинату у фумарат у циклі трикарбонових кислот.
Багато флавінових ферментів утворюють комплекси з металами. Наприклад, ксантиноксидаза, яка каталізує окиснення гіпоксантину та ксантину в сечову кислоту, містить 2 молекули ФАД, 2 атоми молібдену й 8 атомів заліза.
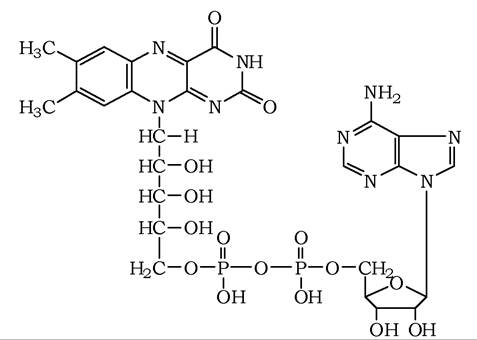
Рис. 8.13. Структура ФАД
Потреба у вітаміні й поширення у природі. Специфічні захворювання, пов'язані з дефіцитом рибофлавіну, що призводять до небезпечних наслідків, майже не зустрічаються. У дослідах на експериментальних тваринах спостерігали запальні процеси слизової оболонки язика, губ (особливо куточків), епітелію шкіри тощо, а також кератити, запалення рогівки, катаракти. Спостерігалась загальна й серцева слабкість. Вітамін достатньо розповсюджений у природі. Людина одержує його з молочними продуктами, яйцями, добова його потреба становить 1,8-2,6 мг. До дефіциту приводять такі чинники, як артрит, туберкульоз, вживання антибіотиків, транквілізаторів, сульфамідних препаратів.